微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确的是?
A.c(K+)>c(Na+)>c(H+)>c(OH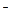 )
)
B.c(Na+)+c(K+)+c(H+)=c(SO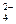 )+c(HS
)+c(HS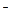 )+c(OH
)+c(OH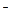 )+c(S2一)
)+c(S2一)
C.c(SO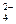 )>c(HS
)>c(HS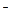 )>c(OH
)>c(OH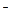 )>c(H+)
)>c(H+)
D.c(K+)+c(S2一)+c(H2S)+c(HS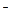 )+c(SO
)+c(SO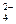 )
)
参考答案:CD
本题解析:由题意知K2S和NaH来源:91考试网 91exam.orgSO4等物质的量混合,设各1mol,则反应后K+:2mol,Na+:1mol,SO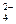 :1mol,HS
:1mol,HS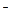 :1mol。因HS
:1mol。因HS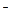 既发生水解又发生电离,且水解程度大于电离程度,则溶液中c(OH
既发生水解又发生电离,且水解程度大于电离程度,则溶液中c(OH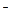 )>c(H+),A项错误;再根据物料守恒可得n(HS
)>c(H+),A项错误;再根据物料守恒可得n(HS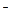 )+n(S
)+n(S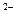 )+n(H2S)=1mol,则D项正确;B项不符合电荷守恒。
)+n(H2S)=1mol,则D项正确;B项不符合电荷守恒。
本题难度:一般
2、选择题 在某无色酸性溶液中能大量共存的一组离子是( )
A.Na+、K+、HCO3-、NO3-
B.NH4+、SO42-、Al3+、NO3-
C.Na+、Ca2+、NO3-、CO32-
D.K+、MnO4-、NH4+、NO3-
参考答案:A.H+与HCO3-反应生成CO2而不能大量共存,故A错误;
B.酸性条件下,离子之间不发生任何反应,可大量共存,故B正确;
C.酸性条件下,H+与CO32-反应生成CO2而不能大量共存,并且CO32-与Ca2+反应生成沉淀,故C错误;
D.MnO4-有颜色,不符合题目无色的要求吗,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
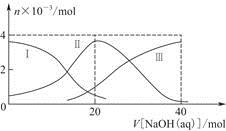
A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为H2A===HA-+H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小
参考答案:A
本题解析:当V[NaOH(aq)]=20 mL时,c(HA-)>c(A2-)>c(H2A),可知NaHA的电离程度大于其水解程度,溶液显酸性,A项正确;NaHA电离出的H+抑制了水的电离,B项错误;H2A为弱酸,其电离过程是可逆的,C项错误;NaHA溶液在稀释过程中酸性降低,pH升高,D项错误。
本题难度:一般
4、选择题 有人欲配制含有下列四种离子的溶液,其中能配制成功的是( )
A.Ca2+、H+、Cl-、HCO3-
B.Mg2+、Al3+、Cl-、SO42-
C.Na+、H+、NO3-、OH-
D.NH4+、Ag+、HCO3-、OH-
参考答案:B
本题解析:A中H+和HCO3-以及OH-不能大量共存;同样OH-和HCO3-不能大量共存,所以正确的答案选B。
本题难度:简单
5、选择题 在强酸性 溶液中,能大量共存的离子是
溶液中,能大量共存的离子是
A.Ca2+、K+、HCO3—、OH—?B.Fe2+、Cl—、H+、Na+
C .Fe2+、Mg2+、Cl—、OH—?D.Ba2+、NH4+、S
.Fe2+、Mg2+、Cl—、OH—?D.Ba2+、NH4+、S O42—、Cl—
O42—、Cl—
参考答案:B
本题解析:略
本题难度:一般