微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)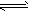 Fe(s)+CO2(g)△H>0。
Fe(s)+CO2(g)△H>0。
(1)其平衡常数可表示为______________, 温度降低,化学平衡移动后达到新的平衡,高炉内CO2和
CO的体积比值____,平衡常数K值_____(本小题空格均备选:增大、减小或不变)
(2)已知1100℃时K=0.263。1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是
υ正___υ逆(选填“大于”、“小于”或“等于”),其原因是___________。
参考答案:(1)c(CO2)/c(CO);减小;减小
(2)否;>;Q<K,平衡正向移动
本题解析:
本题难度:一般
2、填空题 (12分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g) △H1= +131kJ/mol
C(s)+O2(g)=CO2(g) △H2= —394kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H3= —283kJ/mol
则CO(g)+H2O(g) H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 反应达平衡时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 5
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验l中以 CO2表示的反应速率为 。
②在900℃时,此反应的平衡常数K=
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,达到新平衡时CO的转化率将 (变大、变小、不变)
(3)将标准状况下224mLCO2通入200mL 0.1 mol/L KOH溶液中,充分反应后得到溶液X,若不考虑溶液体积的变化,下列有关X的叙述不正确的是
A、c(OH-)=c(H+)+ c(HCO3—)+ 2c(H2CO3)
B、该溶液中,c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+)
C、该溶液中,水电离出的c(OH-)大于水电离出的c(H+)
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则该电池负极的反应式为 。
若将该电池作电源,以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,理论上至少需要消耗标况下的CO气体 mL
参考答案:(1)-41(2分)
(2)①0.16mol/(L·min)(2分);②1/6(2分);③变小;(1分)
(3)C(1分);
(4)CO-2e-+4OH-=CO32-+2H2O(2分);224(2分)
本题解析:(1)根据盖斯定律,所求热化学方程式的热效应△H=△H1-△H2+2△H3=+131kJ/mol-(—394kJ/mol)+2×(—283kJ/mol)=-41kJ/mol;
(2)①实验l中,CO的物质的量减少4-2.4=1.6mol,则二氧化碳的物质的量增加1.6mol,所以以 CO2表示的反应速率为1.6mol/2L/5min=0.16mol/(L·min);
②在900℃时,此反应平衡时c(CO)=1.6mol/2L=0.8mol/L,c(H2)= c(CO2)=0.4mol/2L=0.2mol/L,c(H2O)=(1-0.4)mol/2L=0.3mol/L,所以该温度的平衡常数K= c(H2)·c(CO2)/ c(CO)·c(H2O)=1/6;
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,则c(CO2)=(0.4+0.4)mol/2L=0.4mol/L,c(H2O)=(1-0.4+0.4)mol/2L=0.5mol/L,则Qc=1/5>1/6,所以平衡逆向移动,则CO的转化率变小;
(3)标准状况下224mLCO2的物质的量是0.224L/22.4L/mol=0.01mol, 200mL 0.1 mol/L KOH溶液中KOH的物质的量是0.2L×0.1mol/L=0.02mol,所以二氧化碳与氢氧化钾反应生成碳酸钾和水。A、符合质子守恒定律,正确;B、碳酸钾溶液中,碳酸根离子水解,所以碳酸根离子浓度小于钾离子浓度,水解使溶液呈碱性,所以c(OH-) > c(HCO3—)> c(H+),所以c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+),正确;C、水电离产生的氢氧根离子与氢离子的浓度始终相等,错误,答案选C;
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则负极发生氧化反应,CO发生氧化反应,与氢氧根离子结合生成碳酸根离子和水,电极反应式为CO-2e-+4OH-=CO32-+2H2O;以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,Cu2++2e-==Cu,则转移电子的物质的量是0.64g/64g/mol×2=0.02mol,根据得失电子守恒,则需要CO在标准状况下的体积是0.02mol/2×22.4L/mol=224mL。
考点:考查盖斯定律的应用,化学平衡的移动,平衡常数的计算,离子浓度的比较,电化学反应原理的应用
本题难度:困难
3、选择题 反应Cl2+H2O HCl+HClO达平衡时,欲使HClO浓度增大,应加入( )
HCl+HClO达平衡时,欲使HClO浓度增大,应加入( )
A.CaCO3
B.HCl
C.NaOH
D.H2O