微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。
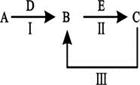
(1)若A为短周期常见金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。用离子方程式表示B溶液pH>7的原因?;
(2)若A是淡黄色化合物;常温下D是无色气体;C为常见强碱,含有的阴、阳离子均为10电子粒子。
① C中所含化学键的类型是?;
②写出反应I的化学方程式?;
③将一定量的气体D通入2 L? C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为?,a点溶液中各离子浓度由大到小的顺序是?。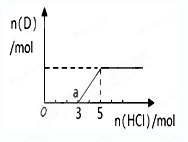
参考答案:(1)AlO2 - + 2H2O Al(OH)3 + OH -
Al(OH)3 + OH -
(2)①离子键和共价键?②2Na2O2+2CO2==2Na2CO3+O2
③NaOH和 Na2CO3?,?c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
本题解析:(1)根据已知条件可知,A是铝,D是氢氧化钠,B是偏铝酸钠,C是氯化铝,E是盐酸。膦甲酸钠由于AlO2-水解显碱性,方程式为AlO2 - + 2H2O Al(OH)3 + OH -。
Al(OH)3 + OH -。
(2)①淡黄色化合物是过氧化钠,即A是过氧化钠,则D是CO2,B是碳酸钠,C是氢氧化钠。氢氧化钠是含有离子键和极性键的离子化合物。
②过氧化钠和CO2反应的方程式为2Na2O2+2CO2==2Na2CO3+O2。
③由于碳酸钠和氯化氢反应是分布进行的,根据图像可知,生成CO2消耗的氯化氢小于o→a反应消耗的氢氧化钠,这说明o点含有的溶质是氢氧化钠和碳酸钠。A点恰好是碳酸氢钠,由于碳酸氢钠的水解程度大于电离程度,溶液显碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(Cl-) >c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
本题难度:一般
2、推断题 A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物已略去)。
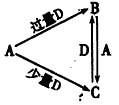
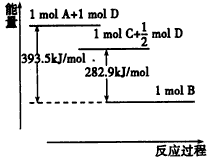
(1)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如下图,请写出反应A+D→C的热化学方程式:________________________。
(2)若A为金属单质,D是某强酸的溶液,则反应C+D→B的离子方程式是______________。
(3)若A、B为盐,D是强碱,A的水溶液显酸性,B的水溶液显碱性。
①C的化学式为______________。
②反应B+A→C的离子方程式为____________________。
(4)若A为强碱,D为气态氧化物。常温时将B的水溶液露置于空气中,其pH随时间t的变化可能如图a或图b所示(不考虑D的溶解和水的挥发)。
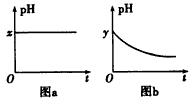
①若图a符合事实,则D为__________(填化学式),图a中的x_______7(填“>”“<”或“=”)。
②若图b符合事实,则其pH变化的原因是____________________(用离子方程式表示);已知图b中y<7,B的焰色反应为黄色,则B溶液中各离子的浓度由大到小的顺序是____________________。
参考答案:
(1)C(s)+1/2O2(g)=CO(g) △H=-110.6 kJ/mol
(2)3Fe2++4H++NO3-=3Fe3+ +NO↑+2H2O
(3)①Al(OH)3;②Al3++3AlO2-+6H2O=4Al(OH)3↓
(4)①CO2;>;②2HSO3-+O2=2H++2SO42-;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
本题解析:
本题难度:困难
3、填空题 (15分)钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白:

(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);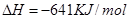
②

则 ____________
____________
反应:

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
参考答案:(1)(2分)2Cl-+2H2O  Cl2↑+H2↑+2OH-?
Cl2↑+H2↑+2OH-?
(2)-512 KJ/mol (2分)
Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应(2分)
(3)2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO(3分)
2FeCl3+2TiCl4+6CO(3分)
(4)增大(2分)? CH3OH-6e-+8OH-=CO32-+6H2O(2分)?(5)12?(2分)
本题解析::(1)电解食盐水生成NaOH、H2和Cl2,
利用盖斯定律2①-②即可计算出反应热为-512 KJ/mol。由于Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应,所以反应要在Ar气氛中进行。
(3在碱性环境中正极: O2 + 4e- + 2H2O= 4OH- ,所以正极附近的碱性增强。负极甲醇发生氧化反应,CH3OH-6e-+8OH-=CO32-+6H2O
(5)CO(g)+2H2(g)←→ CH3OH(g)
4?32
X? 96t
x="12" t
点评:本题以学生不熟悉的金属钛(Ti)为题眼,结合化学工艺,考查的知识面广,但是设计的知识点简单。注重对基础知识点的考查。
本题难度:一般
4、填空题 下图为物质A~I的转化关系(部分反应物、生成物没有列出)。其中B为某金属矿的主要成分,经过一系列反应可得到E和F。D、E常温下为气体,D、F为常见单质,单质F可与H的浓溶液加热时发生反应。
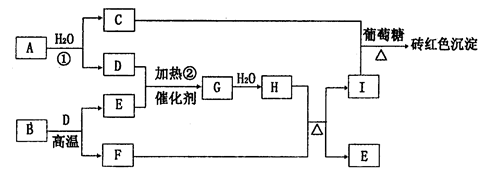
请回答下列问题:
(1)写出G的化学式:________________。
(2)反应①的离子方程式为__________________。
(3)单质F与H的浓溶液发生反应的化学方程式为______________________。
(4)用Pt作电极电解I溶液,完全电解后的电解质溶液是_______________,其阳极的电极反应式为____________________。
(5)已知每16gE与D完全反应,放出24.75 kJ热量,则反应②的热化学方程式为
________________________________________________.
(6)工业制备G时,混合气体的组成中E占7%、D占11%,现有100体积混合气体进入反应装置,导出的气体恢复到原温度和压强后变为97.2体积。则E的转化率为________.
参考答案:(1) SO3 ?(2分)
(2) 2Na2O2+2H2O═4Na+ + 4OH- + O2↑ ?(2分)
(3) Cu + 2H2SO4 (浓) ?CuSO4 + SO2↑ + 2H2O ?(2分)
?CuSO4 + SO2↑ + 2H2O ?(2分)
(4) H2SO4?(2分)? 4OH-→2H2O + O2↑+4e-?(2分)
(5)2SO2(2分)+ O2(g) 2SO3(2分)? △H=" -198" kJ·mol-1?(2分)
2SO3(2分)? △H=" -198" kJ·mol-1?(2分)
(6)80% ?(2分)
本题解析:略
本题难度:简单
5、推断题 有关物质存在如图所示的转化关系(部分产物已省略)。通常状况下C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取 气体单质H。 请回答下列问题:
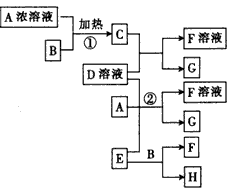
(1)反应①的化学方程式为____。
(2)反应②的离子方程式为____。
(3)写出另外一种实验室制取H的化学方程式____________。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Kap=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为0.01 mol·L-1,则生成沉淀所需Pb(NO3)2溶液的最小浓度为________。
参考答案:(1)反应①中的化学方程式:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)反应②的离子方程式: 6I-+ClO3-+6H+==3I2+Cl-+3H2O
(3)2H2O2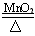 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(4)5.6×10-4mol·L-1
本题解析:
本题难度:一般