| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》试题巩固(2017年最新版)(十)
参考答案:B 本题解析:略 本题难度:一般 3、选择题 下列操作会使H2O的电离平衡向电离方向移动且pH<7的是( ) 参考答案:B 本题解析: 本题难度:简单 4、选择题 室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是 |
参考答案:C
本题解析:A.当x=0.2,则混合后二者恰好完全反应产生NaHA。若NaHA是强酸的酸式盐或是弱酸的酸式盐,HA-的电离大于其水解作用,则溶液显酸性,y小于7,若NaHA是弱酸的酸式盐,HA-的水解大于其电离作用,则溶液显碱性,y大于7,正确;B.当x=0.2,y=1,反应产生NaHA ,c(NaHA)=0.1mol/L。由于y=1,即c(H+)=0.1mol/L,NaHA是强酸的酸式盐,则根据物料守恒可得混合溶液中:c(H+)= c(A-) +c(OH-),正确;C.当x=0.3,则反应产生的是NaHA、Na2A等浓度的混合溶液。y>7,则混合溶液中离子浓度关系是c(Na+) >c(HA-)>c(A2-)> c(OH-)>c(H+),错误;D。当x=0.4,反应反应产生Na2A。则根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+ c(HA-)+ 2c(A2-)。全部大于部分的和,因此混合溶液中:[c(Na+)+ c(H+)]>2c(A2-),正确。
考点:考查酸碱混合溶液中离子的浓度大小比较的知识。
本题难度:一般
5、实验题 (12分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。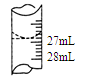
(3)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
参考答案:(12分)
(1)锥形瓶 酸式滴定管 溶液由黄色变为橙色且半分钟内不褪色
(2)26.30mL
(3)0.1052mol/L
(4)AC(答对一个给1分,
本题解析:(1)用盐酸滴定氢氧化钠溶液的浓度时,氢氧化钠溶液盛放在锥形瓶中,标准盐酸用酸式滴定管盛放;选择甲基橙做指示剂,甲基橙的变色范围是3.1-4.4,开始溶液呈黄色,滴定终点时,溶液由黄色变为橙色,且半分钟内不褪色;
(2)滴定后液面的读数是26.80mL,滴定前滴定管内液面读数为0.50mL,所以消耗标准液的体积是26.80-0.50=26.30mL;
(3)第二组的数据为31.30-1.56=29.74mL,第三组数据为27.31-1.00=26.31mL,所以第二组数据偏差较大,故舍去;所以消耗盐酸的体积平均值是(26.31+26.29)/2=26.30mL,则氢氧化钠溶液的浓度为26.30mL×0.1000mol/L/25.00mL=0.1052mol/L;
(4)A、锥形瓶用待测液润洗,会使待测液的体积偏大,所以消耗标准液的体积偏多,则待测液的浓度偏高;B、酸式滴定管用蒸馏水洗后就应用标准液润洗,对结果无影响,错误;C、滴定前酸式滴定管尖端气泡未排除,导致滴定前的读数偏小,滴定后气泡消失,则导致两次读数之差偏大,待测液的浓度偏高;D、滴定前读数正确,滴定后俯视滴定管读数,导致末读数偏小,则待测液的浓度偏低,所以答案选AC。
考点:考查中和滴定的实验操作、误差分析
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《无机综合与推断》.. | |