| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》试题预测(2017年最新版)(四)
参考答案:C 本题解析:假如酸是强酸,则酸和碱恰好反应显中性,其物质的量应该相等,,即体积相等时,a=b;假如酸为弱酸,pH=7,酸应该过量,体积相等时,a>b;故,A、B错;要显中性,c(H+)=c(OH-),根据电荷守恒,则c(Na+)=c(A-),D错;答案选C。 本题难度:一般 3、选择题 下列有关水的电离的说法正确的是( ? ) 参考答案:D 本题解析: 本题难度:一般 4、选择题 下列表述中,合理的是 |
参考答案:D
本题解析:加热促进FeCl3水解,加热蒸干可得到 固体,故A错误;阴极反应为
固体,故A错误;阴极反应为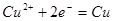 ,当有0.2 mol电子转移时阴极会析出6.4g铜,故B错误;用酸式滴定管量取高锰酸钾溶液,故C错误;加热,水的电离平衡正向移动,Kw增大,pH变小,故D正确。
,当有0.2 mol电子转移时阴极会析出6.4g铜,故B错误;用酸式滴定管量取高锰酸钾溶液,故C错误;加热,水的电离平衡正向移动,Kw增大,pH变小,故D正确。
考点:本题考查水溶液。
本题难度:一般
5、实验题 (14分)I.如下图所示,50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在装置中进行中
和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题: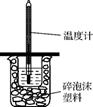
(1)图中装置缺少的仪器是 。
(2)下列说法不正确的是 (填序号)。
A.若用50mL0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______________,直至滴定终点。判断到达终点的现象是__________________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL则c(HCl)= 。
(4)下列操作中,可能造成测定结果偏高的是 。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
参考答案:I.(1)环形玻璃搅拌棒 (2)BC II.(1)BDCEAF 或ABDCEF (2)锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。 (3)0.075mol/L (4)AD
本题解析:
试题解析:I.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;(2)醋酸是弱电解质,电离要吸热,测得的中和热数据会偏小,故B应选;硫酸雨氢氧化钡反应,除生成水外还生成硫酸钡,放出热量增多,使中和热数据偏大,故C应选;II.(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF;(2)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;(3)16.80 mL与其它数据差别过大,舍去,则V(NaOH)(平均消耗)==1/2(14.98 +15.02)mL=15.00mL,c(HCl)=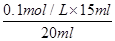 =0.075mol/L;(4)未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=
=0.075mol/L;(4)未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=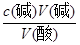 ,可知c(酸)偏高,故A正确;滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=
,可知c(酸)偏高,故A正确;滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=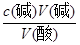 ,可知c(酸)偏小,故B错误;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=
,可知c(酸)偏小,故B错误;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=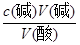 ,可知c(酸)不变,故C错误;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=
,可知c(酸)不变,故C错误;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=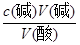 ,可知c(酸)偏高,故D正确。
,可知c(酸)偏高,故D正确。
考点:酸碱中和滴定
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《有关氧化还.. | |