| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《难溶电解质的溶解平衡》高频考点巩固(2017年模拟版)(四)
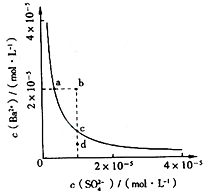 参考答案:A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故A错误; 本题解析: 本题难度:简单 3、选择题 常温下KSp(AgCl)=1.8×10-10, KSp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法不正确的是( ) 参考答案: 本题解析: 本题难度:一般 4、选择题 在100mL 0.01mol/L KCl溶液中,加入1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10 mol2/L2)? (? ) 参考答案:A 本题解析:本题主要利用浓度商与溶度积的大小比较,判断是否有沉淀生成。通过计算可以看出加入溶液后Qc>Ksp(AgCl),因此应当有AgCl沉淀析出。 本题难度:简单 5、选择题 下列说法不正确的是 参考答案:D 本题解析:A正确,Ba2+加入后产生同离子效应,沉淀增加;B正确,若为弱酸,则PH<7,若为强酸,则PH=7;C正确,水杨酸电离的H+会抑制平衡,难以显紫色,无法检验酚羟基;D错,还可能含有Cl-等。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《氯及其化合.. | |