微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列过程所发生的化学变化属于取代反应的是:
A.苯与液溴在FeBr3催化作用下反应
B.苯与氢气在镍做催化剂的条件下反应
C.乙烯在空气中燃烧
D.乙醇在铜做催化剂的条件下生成乙醛
参考答案:A
本题解析:有机物分子的某些原子或原子团被其它原子或原子团所代替生成其它物质的反应是取代反应,所以选项A正确。B是加成反应,CD都是氧化反应,答案选A。
本题难度:困难
2、选择题 下列物质中不能与钠发生反应的是
A.乙醇
B.乙酸
C.水
D.煤油
参考答案:D
本题解析:试题分析:乙醇、乙酸和水都和钠反应生成氢气,但煤油不能,钠一般保存在煤油中,答案选D。
考点:考查钠的性质
点评:该题是基础性试题的考查,试题注重基础,侧重对金属钠性质的考查,有利于巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力。该题难度不大,记住即可。
本题难度:困难
3、选择题 在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是
A.滴加酚酞试液显红色的溶液Fe3+、NH4+、Cl-、SCN-
B.水电离出来的c(H+)=10-13mol/L的溶液K+、HCO3-、Br-、Ba2+
C.所含溶质为Na2SO4的溶液K+、CO32-、NO3-、Ca2+
D.pH=1的溶液Cu2+、Na+、Mg2+、NO3-
参考答案:D
本题解析:分析:A.滴加酚酞试液显红色的溶液呈碱性,溶液中存在大量的OH-离子;
B.水电离出来的c(H+)=10-13mol/L的溶液可能呈酸性,也可能呈碱性;
C.所含溶质为Na2SO4的溶液中,与SO42-反应生成沉淀的离子不能存在,
D.pH=1的溶液呈酸性,溶液中存在大量的H+离子.
解答:A.滴加酚酞试液显红色的溶液呈碱性,溶液中存在大量的OH-离子,Fe3+与OH-或SCN-都不能大量共存,故A错误;
B.水电离出来的c(H+)=10-13mol/L的溶液可能呈酸性,也可能呈碱性,无论溶液呈酸性还是碱性,HCO3-都不能存在,故B错误;
C.所含溶质为Na2SO4的溶液中,与SO42-反应生成沉淀的Ca2+离子不能存在,故C错误;
D.pH=1的溶液呈酸性,溶液中存在大量的H+离子,在酸性条件下,四种离子不发生任何反应,能大量共存,故D正确.
故选D.
点评:本题考查离子共存,题目信息量较大,难度中等,解答本题时要注意把握各项前提条件,熟练掌握离子的性质.
本题难度:一般
4、选择题 若100 mL 0.1 mol·L-1硫酸铝溶液与氢氧化钠溶液反应,得到1.17g沉淀,则需0.5 mol·L-1NaOH溶液
A.130mL
B.100mL
C.90mL
D.50mL
参考答案:AC
本题解析:设所需NaOH溶液的体积为V。
若Al3+过量:
Al3++3OH- Al(OH)3↓
Al(OH)3↓
3 mol? 78 g
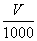 ×0.5 mol·L-1?1.17 g
×0.5 mol·L-1?1.17 g
解得V="90" mL。
若OH-过量:
Al3+ + 3OH-? Al(OH)3↓
Al(OH)3↓
1mol ?3 mol? 78 g
0.02 mol ?0.06 mol 1.56 g
Al(OH)3+ OH-?![]()
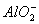 +2H2O
+2H2O
78 g?1 mol
(1.56-1.17)g ?0.005 mol
则: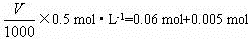
V=130mL。
本题难度:简单
5、选择题 在相同温度下,等体积,等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S中含带电微粒数由多到少的顺序是
A.①=④>③=②
B.④=①>③>②
C.④>①=③>②
D.④>①>③>②
参考答案:D
本题解析:分析:先根据n=CV计算溶质的物质的量,再根据溶质的电离和水解分析带电微粒的多少.
解答:等体积,等物质的量浓度的4种稀溶液,根据n=CV知,各溶质的物质的量相等.
Na2SO4、NaHSO3、Na2S是强电解质,在水中完全电离;Na2SO4、Na2S中阳离子和阴离子个数比为2:1,NaHSO3中阳离子和阴离子个数比为1:1,所以硫酸钠和硫化钠的溶液中阴阳离子数大于亚硫酸氢钠溶液中的阴阳离子数;硫酸钠是强酸强碱盐,在水中不水解,硫化钠是强碱弱酸盐,在水中水解导致溶液中带电荷的微粒数增多,所以硫化钠溶液中的带电微粒数大硫酸钠溶液中的带电微粒数;亚硫酸是弱电解质,只有部分电离,所以亚硫酸溶液中带电微粒数最少,所以①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S中含带电微粒数由多到少的顺序是④>①>③>②.
故选D.
点评:本题考查了溶液中带电微粒多少的判断,难度较大,注意:强酸弱碱盐或强碱弱酸在水中以电离为主,水解是微弱的.
本题难度:一般