微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于电子云的叙述中不正确的是
[? ]
A.电子云是用小黑点的疏密程度来表示电子在空间出现概率大小的图形
B.电子云实际是电子运动形成的类似云一样的图形
C.点密集的地方电子出现的概率大
D.轨道不同,电子云的形状也不一样
参考答案:B
本题解析:
本题难度:简单
2、选择题 元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为
[? ]
A.9
B.10
C.17
D.18
参考答案:C
本题解析:
本题难度:简单
3、简答题 氮是地球上极为丰富的元素.
(1)Li3N晶体中氮以N3-存在,基态N3-电子排布式为:______
(2)N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol.计算说明N2中的______键比______键稳定(填σ和π)
(3)已知Pt(NH3)2Cl2分子是平面结构.请画出Pt(NH3)2Cl2可能的平面结构简式:______.
(4)下列分子中若为手性分子,请用*标出手性碳原子.
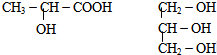
参考答案:(1)N原子原子序数为7,N3-离子原子核外共有10个电子,且最外层达到稳定结构,根据能量最低原理可写出电子排布式为1S22S22P6,
故答案为:1S22S22P6;
(2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为942-2472kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定,故答案为:π;σ;
(3)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置,故答案为:
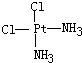
、

;
(4)手性碳原子连接四个不同的原子或原子团,前者有手性碳原子,后者没有,
故答案为:
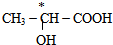
.
本题解析:
本题难度:一般
4、简答题 C和Si元素在化学中占有极其重要的地位.
(1)写出Si原子核外最外层电子排布式______.?C、Si和O元素的原子半径由小到大的顺序为______.
(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是______.SiC晶体熔点______?晶体硅(填<、>、=).
(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显______性,相关的离子方程式______.
(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有______.(举一例说明)
参考答案:(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;在元素周期律中,同一周期,元素的原子半径随着原子序数的增大而减小,同一周期,元素的原子半径随着原子序数的增大而增大,所以C、Si和O元素的原子半径由小到大的顺序为?O<C<Si.
?故答案为:3s23p2;?O<C<Si.
?(2)非金属元素之间易形成共价键(铵盐除外),所以SiC的晶体结构中微粒间存在的作用力是共价键;碳化硅和硅相似,都是原子晶体,原子晶体的熔点与组成元素的原子半径有关,原子半径越小,熔点越高,SiC晶体中碳原子的原子半径小于硅原子的原子半径,所以碳化硅晶体的熔点大于晶体硅的熔点.
故答案为:共价键;>.
(3)氧化物MO的电子总数与SiC的相等,所以M是镁元素,氯化镁是强酸弱碱盐,所以其水溶液呈酸性;弱离子镁离子能发生水解生成氢氧化镁和氢离子Mg2++2H2O?Mg(OH)2+2H+,导致溶液中氢离子的浓度大于氢氧根离子的浓度,所以溶液呈酸性.
故答案为:酸性;Mg2++2H2O?Mg(OH)2+2H+.
(4)将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
故答案为:将二氧化碳通入硅酸钠溶液中,有硅酸钠沉淀析出,根据强酸制取弱酸知,碳酸的酸性大于硅酸的酸性,所以碳的非金属性大于硅的非金属性.
本题解析:
本题难度:一般
5、简答题 A、B-、C、D、E、F都是含有18个电子的微粒(分子或单核离子),请回答:
(1)A是单原子分子,则A的原子结构示意图是______;
(2)B的最高价氧化物对应的水化物的化学式为______;
(3)C是由两种元素组成的三原子分子,其存在的共价键类型为______;
(4)D是所有18个电子的微粒中氧化能力最强的分子,其分子式是______;
(5)E是由两种元素组成的四原子分子,其分子式为______?或______;
(6)F分子含有8个原子,其结构简式为______.
参考答案:(1)原子中,核外电子数=核内质子数=原子序数=18,所以该元素是氩,其原子结构示意图为:

;
故答案为:

.
(2)阴离子中,原子序数=核外电子数-电荷数=核内质子数,主族元素的最高化合价=其最外层电子数,B-含有18个电子,所以B元素是氯元素,属于第ⅤⅡA族,其最高化合价为+7价,所以最高价氧化物对应的水化物的化学式为HClO4.
故答案为:HClO4.
(3)三核18电子的分子为H2S,不同非金属元素间易形成极性共价键,所以氯化氢中含有极性共价键.
故答案为:极性共价键;
(4)氧化能力最强且含18电子的分子是氟气.
故答案为:F2;
(5)由两种元素组成的四原子且含18电子的分子,其平均原子量为4.5,所以应有原子量大于4.5的原子,原子量小于4.5的原子,所以原子量小于4.5的非金属元素且能形成化合物的是氢元素,所以一定含有氢元素;所以两种元素组成的四原子且含18电子的分子为H2O2?或PH3;
故答案为:H2O2?或PH3.
(6)含有8个原子且含18电子的分子是乙烷.
故答案为:CH3CH3.
本题解析:
本题难度:一般