| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《电解质和非电解质》在线测试(2017年最新版)(十)
参考答案:B 本题解析:乙醇是非电解质,不能电离出氢离子。A、C、D均是电解质,能电离出氢离子,所以答案选B。 本题难度:一般 2、填空题 现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- 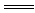 H2O,该离子反应对应的化学方程式为 。 H2O,该离子反应对应的化学方程式为 。(3)⑩在水中的电离方程式为  , ,1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为 。 (4)少量的④通入⑥的溶液中反应的离子方程为 。 参考答案:(1)按物质的分类方法填写表格的空白处: 本题解析:略 本题难度:一般 3、选择题 由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是 |
参考答案:D
本题解析: A.混盐Na4S2O3是由一种阳离子和两种酸根离子组成的,则阳离子是钠离子,阴离子应该是亚硫酸根和硫离子,酸根均水解溶液显碱性,A正确;B.该混盐与H2SO4反应有气体SO2和H2S生成,B正确;C.该混盐溶液加入BaCl2可以生成亚硫酸钡白色沉淀,C正确;D.该混盐在酸性条件下可生成S,反应的方程式为2S2-+SO32-+6H+=3H2O+3S↓,则每产生32g S转移4/3NA个电子,D错误,答案选D。
考点:考查盐类水解、氧化还原反应的有关判断
本题难度:一般
4、选择题 分类思想是学习化学的重要思想,从分类的角度分析正确的是
A.SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物
B.Na2O和NH3的水溶液均能导电,故均为电解质
C.Si和SiO2均属于原子晶体
D.Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物
参考答案:C
本题解析:A.能与碱反应生成盐和水的氧化物是酸性氧化物,SO2是酸性氧化物NO2溶于水生成硝酸和NO,不是酸性氧化物,A错误;B.溶于水或熔融状态下能自身电离出离子的化合物是电解质,Na2O所以电解质,氨气不能自身电离出离子,是非电解质,B错误;C.Si和SiO2均属于原子晶体,C正确;D.能与酸反应生成盐和水的氧化物是碱性氧化物,Na2O是碱性氧化物,Na2O2与水反应生成氢氧化钠和氧气,不是酸性氧化物,D错误,答案选C。
考点:考查物质分类的有关判断
本题难度:简单
5、填空题 按要求填空,(每空2分,共6分)
双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_______________
(2)写出实验室用双氧水制取氧气的化学方程式:
(3)鉴于H2O2显弱酸性,它可以同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:______________
参考答案:(1)H2O2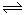 H++HO2-、HO2-
H++HO2-、HO2-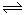 H++ O22-
H++ O22-
(2)2H2O2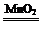 2H2O+O2↑
2H2O+O2↑
(3)H2O2 + Ba(OH)2 ="=" BaO2 +2H2O
本题解析:(1)把H2O2看成是二元弱酸,则在水溶液中部分电离产生氢离子,电离方程式是H2O2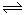 H++HO2-、HO2-
H++HO2-、HO2-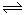 H++ O22-
H++ O22-
(2)过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气,化学方程式为2H2O2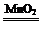 2H2O+O2↑;
2H2O+O2↑;
(3)H2O2看成是二元弱酸,与氢氧化钡反应生成的正盐是BaO2,所以过氧化氢与氢氧化钡反应生成过氧化钡和水,化学方程式为H2O2 + Ba(OH)2 ="=" BaO2 +2H2O。
考点:考查对过氧化氢的认识,酸碱中和反应化学方程式的书写
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《电解池的应用》试.. | |