微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
[? ]
A.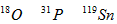
B.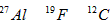
C.元素周期表中VA族所有元素的原子
D.元素周期表中第1周期所有元素的原子
参考答案:C
本题解析:
本题难度:一般
2、填空题 按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为______________。
参考答案:6 ;ⅣA ;PbO2
本题解析:
本题难度:一般
3、选择题 根据现行元素周期表的排布规律,如果第七周期排满,下列预测正确的是
[? ]
A.第七周期共有50种元素
B.第七周期最后一种元素不与任何物质发生反应
C.第七周期ⅦA族元素的原子在化学反应中可以得到1个电子
D.第七周期任何一种元素的原子最外层上不超过8个电子
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列结论正确的是( )
①微粒半径:Fe(OH)3胶粒>S2->Cl>S>F?②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:Fe3+>Cu2+>Fe2+>Zn2+?④单质氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4?⑥熔沸点:Na>H2O>HF>HCl.
A.①②④
B.②④⑥
C.只有①
D.只有⑥
参考答案:①胶体的粒子半径大于离子和原子,电子层越多,半径越大,同周期从左向右原子半径在减小,则Fe(OH)3胶粒>
S2->S>Cl>F,故①错误;
②非金属性越强,气态氢化物越稳定,非金属性F>Cl>S>Se,则氢化物稳定性为HF>HCl>H2S>H2Se,故②正确;
③金属性越强,对应离子的氧化性越弱,金属性Zn>Fe>Cu,则离子氧化性为Fe3+>Cu2+>Fe2+>Zn2+,故③错误;
④非金属性越强,对应单质的氧化性越强,非金属性Cl>S>Se>Te,单质氧化性:Cl2>S>Se>Te,故④正确;
⑤非金属性越强,对应的最高价含氧酸的酸性越强,非金属性Cl>S>Se,则酸性为HClO4>H2SO4>H2SeO4,故⑤错误;
⑥金属晶体的熔沸点大于分子晶体的,但分子晶体中含有氢键的沸点反常的高,则熔沸点:Na>H2O>HF>HCl,故⑥正确;
故选B.
本题解析:
本题难度:一般
5、推断题 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为
51;Y 原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_______、_______;杂化轨道分别是____、____ ;a分子的立体结构是_______。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)_______。
(4)Y与Z比较,电负性较大的________,W的+2价离子的核外电子排布式是_______。
参考答案:(1)CH4;SiH4;sp3;sp3;正四面体
(2)分子;原子
(3)CO2
(4)C;1s22s22p63s23p63d10
本题解析:
本题难度:一般