参考答案:C
本题解析:略
本题难度:一般
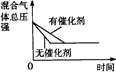
2、选择题 如图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( ) 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气体
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应ΔH>0
参考答案:C
本题解析:在可逆反应X+Y 2Z混合气体中Z的体积分数越大说明反应物的转化率越大。当温度一定时,如图所示设为T1,当压强由10 kPa依次增大至100 kPa、1 000 kPa时在平衡混合物中Z的体积分数依次从Z1减小至Z2、Z3,表明当温度一定时,增大压强,平衡向逆反应方向移动,由此可知,可逆反应X+Y 2Z混合气体中Z的体积分数越大说明反应物的转化率越大。当温度一定时,如图所示设为T1,当压强由10 kPa依次增大至100 kPa、1 000 kPa时在平衡混合物中Z的体积分数依次从Z1减小至Z2、Z3,表明当温度一定时,增大压强,平衡向逆反应方向移动,由此可知,可逆反应X+Y 2Z的逆反应是一个气体体积缩小的反应,据此可知X和Y中只有一种为气态,Z为气态,C选项正确。当压强一定时,升高温度,Z在平衡混合气体中体积分数增大,说明平衡向正反应方向移动,因此该反应的正反应是吸热反应,逆反应是放热反应,所以逆反应的ΔH<0,D错。 2Z的逆反应是一个气体体积缩小的反应,据此可知X和Y中只有一种为气态,Z为气态,C选项正确。当压强一定时,升高温度,Z在平衡混合气体中体积分数增大,说明平衡向正反应方向移动,因此该反应的正反应是吸热反应,逆反应是放热反应,所以逆反应的ΔH<0,D错。
本题难度:一般
3、选择题 在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g) 2Z(g) 2Z(g)
此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:AB
本题解析:正反应是气体物质的量减小的反应,容器内压强不随时间变化时,即气体的物质的量不再变化,各物质的浓度也不再变化,表明该反应达到了平衡状态。
本题难度:一般
4、选择题 在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:
A(s)+2B(g) C(g)+D(g)已达到平衡状态的现象是 C(g)+D(g)已达到平衡状态的现象是
A.混合气体的压强
B.混合气体的密度
C.气体的总物质的量
D.单位时间内生成n mol C的同时消耗2n molB
参考答案:B
本题解析:由反应方程式可以看出,反应前后气体体积不变,但气体的质量发生了改变。因此,当达到化学平衡时,气体的质量应保持不变,混合气体的密度也应保持不变。故答案选B。
点评:化学平衡移动的考查,是历年高考的重点,应特别注意有气体参与的反应。若反应前后气体体积发生变化,则可根据压强、混合气体的密度判断化学平衡。
本题难度:一般
5、选择题 有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲:a(g)+b(g)  2c(g)? ΔH1<0、?乙: x(g)+3y(g) 2c(g)? ΔH1<0、?乙: x(g)+3y(g)  2z(g)? ΔH2>0 2z(g)? ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
A.绝热下向甲中通入惰性气体,c的物质的量不变
B.绝热下向乙中通入z气体,反应器中温度升高
C.恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大
D.恒温下向乙中通入z气体,y的物质的量浓度增大
参考答案:A
本题解析:A、绝热下向甲中通入惰性气体,隔板向右移动,乙中平衡正向移动,吸收热量,中间隔板是导热的,导致甲中温度降低,平衡正向移动,c的物质的量增大,错误;B、绝热下向乙中通入z气体,平衡向放热的逆向移动,反应器中温度升高,正确;C、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中平衡因压缩而正向移动,X、Y的转化率增大,正确;D、恒温下向乙中通入z气体,平衡逆向移动,y的物质的量浓度增大,正确。
本题难度:一般
|