微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 恒容密闭容器中进行的可逆反应2NO2?2NO+O2,达到平衡状态的是( )
①单位时间内生成a?mol O2的同时生成2a?mol?NO2
②单位时间内生成a?mol?O2的同时生成2a?mol NO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
A.①③⑤
B.②④⑤
C.①③④
D.①②③④⑤
参考答案:此题列出了判断可逆反应是否达到平衡状态的各种可能情况,应从平衡状态的两个重要特征上判断(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变.①符合特征(1);②表示的都是正反应方向;③NO2是红棕色气体,颜色不变时说明NO2的浓度保持不变,符合特征(2);④中若是恒容条件,则ρ始终不变;若恒压条件,则ρ随反应而变;⑤也说明符合特征(2).故①③⑤能说明是否达到平衡状态.
故选A.
本题解析:
本题难度:一般
2、填空题 联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g)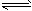 N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______
N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)已知在T℃,2L密闭容器中,加入4mol NO2(g),发现5分钟末反应达平衡时,放出的热量为
57.20kJ,则此时N2O4的体积分数为_________,在此时间内用N2O4表示的反应速率为____________达平衡后,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是_____________
(3)25℃时,1.00g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)==3N2(g)+4H2O(l)的ΔH= ________________ kJ·mol-1。
(4)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、
c(N2O4)=0.0120 mol·L-1。反应2NO2(g)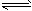 N2O4(g)的平衡常数K=___________
N2O4(g)的平衡常数K=___________
(5)T℃、1.01×105Pa,已知K=1/3,在2L密闭容器中,加入10mol NO2(g) 和4mol N2O4(g),则平衡向生成___________物质的方向移动,再次平衡时,NO2(g)的浓度是_________。
参考答案:(1)BC
(2)33%;0.1mol/(L·min);先加深后变浅,但比原来的要深
(3)-1224.96
(4)13.3
(5)N2O4;3mol/L
本题解析:
本题难度:一般
3、选择题 在一定条件下,对于密闭容器中进行的反应:H2(g)+I2(g)?2HI?(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
A.正、逆反应速率都等于零
B.H2、I2、HI的浓度相等
C.H2、I2、HI在容器中共存
D.H2、I2、HI的浓度均不再变化
参考答案:A.化学平衡为动态平衡,达到平衡时正逆反应速率相等,但不为零,故A错误;
B.平衡时各物质的浓度关系取决于反应物的起始量和转化的程度,H2、I2、HI的浓度相等不能作为达到平衡的依据,故B错误;
C.反应为可逆反应,无论是否达到平衡状态,都存在H2、I2、HI在容器中共存的特点,故C错误;
D.当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,故D正确.
故选D.
本题解析:
本题难度:简单
4、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于?。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
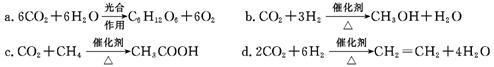
以上反应中,原子利用率最高的是?。
(3)若有4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,试写出该反应的热化学方程式_______________________________________。
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充人1mol CO2和3molH2,进行反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡v(H2)= _____________;该温度下的平衡常数数值=__________。
(5)CO2在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其Ksp="=" 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为______________。
参考答案:(1)保护臭氧层(1分)?(2) C (1分)
(3)CO2(g) +3 H2(g) 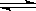 CH3OH(l) +H2O(g)?△H=-49kJ·mol-1(2分)
CH3OH(l) +H2O(g)?△H=-49kJ·mol-1(2分)
(4)0.225mol·L-1·min-1(2分)? 5.3 或 16/3(2分。对单位不做要求,若写了单位但单位错误扣除1分)
(5)2.8×10-5 mol/L(2分,无单位或单位书写错误扣除1分)
本题解析:(1)氟利昂能平衡臭氧层,所以有利于保护臭氧。
(2)反应c反应物中的原子全部转化到目标物质中,原子利用率最高。
(3)4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,则44gCO2放出的热量就是49kJ,所以热化学方程式为CO2(g) +3 H2(g) 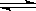 CH3OH(l) H2O(g)△H=-49kJ·mol-1。
CH3OH(l) H2O(g)△H=-49kJ·mol-1。
(4)根据图像可知起始时CO2的浓度是1.00mol/L的,说明容器容积是1L。10min时反应达到平衡状态,平衡时CO2的浓度是0.25mol/L,因此消耗CO2的浓度是0.75mol./L。根据方程式可知消耗氢气的浓度是0.75mol./L×3=2.25mol/L,所以氢气的反应速率为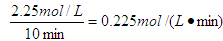 。平衡时
。平衡时
氢气的浓度是3.0mol/L-2.25mol/L=0.75mol/L,所以平衡常数为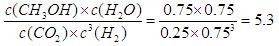
(5)等体积混合后,碳酸钠的浓度变2×10-4mol/L。根据溶度积常数的概念可知,生成沉淀所需
CaCl2溶液的最小浓度为 ,所以混合之前的浓度为2.8×10-5 mol/L。
,所以混合之前的浓度为2.8×10-5 mol/L。
本题难度:一般
5、填空题 (本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
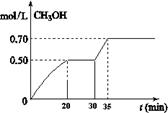
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
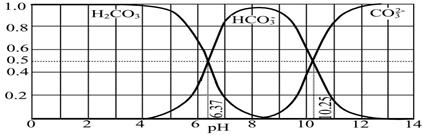
下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
参考答案:31.答案(16分)
(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
本题解析:
本题难度:一般