|
高中化学知识点归纳《化学平衡》高频试题预测(2017年最新版)(六)
2017-08-01 01:47:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,对于密闭容器中进行的可逆反应:N2 + 3H2 2NH3,下列说法中,能充分说明这一反应已经达到化学平衡状态的是( ) 2NH3,下列说法中,能充分说明这一反应已经达到化学平衡状态的是( )
A.N2、H2与NH3的物质的量之比为1
|
参考答案:
本题解析:
本题难度:一般
2、填空题 现有如图所示的转化关系,图中各物质均为常见物质,转化中有部分物质已省略。
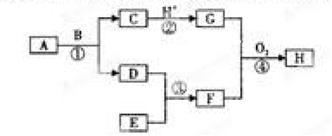
上述物质中C是一种黑色磁性固体,F是极易溶于水且水溶液呈碱性的气体,H是红褐色沉淀,A、D、E均为单质,请回答下列问题:
(1)写出下列物质的化学式:A: 、E
(2)写出④中生成H的非氧化还原反应的离子方程式:
(3)在120℃、1大气压下将168gA和90gB放入1L,密封烧瓶中发生反应①,经过10min达到平衡,平衡后D的质量为4g(固体体积忽略不计),则用D表示10min内的平均反应速率为 ,该温度下此反应的平衡常数K= ,B的转化率是 。
参考答案:(1)Fe(1分) N2(1分)
(2)Fe3++3NH3+H2O==Fe(OH)3↓+3NH4+(2分)
(3)V(H2)=0.2mol·L-1·min-1(2分) K=(2/3)4或2/3(3分) 40%(3分)
本题解析:由题意知,A为Fe,B为H2O,C为Fe3O4,D为H2,E为N2,F为NH3,H为Fe(OH)3。
(2)C为Fe3O4与H+反应后在G中即含有Fe3+又含有Fe2+,故生成H的非氧化还原反应只能是Fe3+生成Fe(OH)3。
(3)反应写出①:3Fe + 4H2O(g) = Fe3O4 + 4H2
开始 166g 90g
10min后 3mol 4g
转化 2mol 2mol
故V(H2)=" 2mol/1L/10min" = 0.2mol·L-1·min-1;
平衡常数K=c4(H2)/ c4(H2O) = (2/3)4;
B的转化率=2mol/5mol=40%。
考点:无机物的推断,化学反应速率、化学平衡常数、转化率的计算
本题难度:一般
3、填空题 已知:2SO3 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题: 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A B(大于;等于;小于);达平衡时SO3的转化率
A B(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体, 容器的平衡将向 方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A ,B
参考答案:
(1)小于;小于(各1分,共2分)
(2)B;正反应;变小;不变(各1分,共4分)
本题解析:
本题考查化学平衡移动;2SO3 2SO2+O2,是一气体总物质的量增大的反应。(1)相同温度下,充入SO3,A容器保持体积不变,压强变大;B容器保持压强不变,体积增大,达到平衡状态时转化为状态C(如下图),故达到平衡所用时间,A小于B;假设B中的活塞不移动,由于A、B两个容器的体积、温度相同,达到平衡时A、B两容器中存在的平衡是等效平衡,其中SO3的转化率也相等。对于B和C两个状态,B中压强小于C中压强,因此C中SO3转化率大于B中SO3转化率。由此可以判断出C中SO3的转化率也大于A中SO3的转化率, 故达到平衡时,SO3的转化率 A小于B。 2SO2+O2,是一气体总物质的量增大的反应。(1)相同温度下,充入SO3,A容器保持体积不变,压强变大;B容器保持压强不变,体积增大,达到平衡状态时转化为状态C(如下图),故达到平衡所用时间,A小于B;假设B中的活塞不移动,由于A、B两个容器的体积、温度相同,达到平衡时A、B两容器中存在的平衡是等效平衡,其中SO3的转化率也相等。对于B和C两个状态,B中压强小于C中压强,因此C中SO3转化率大于B中SO3转化率。由此可以判断出C中SO3的转化率也大于A中SO3的转化率, 故达到平衡时,SO3的转化率 A小于B。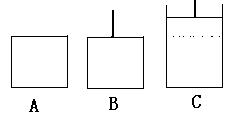
(2)达到平衡后,分别充入惰性气体,A容器体积不变,反应体系的浓度不变,平衡不移动,B容器保持压强不变,体积增大,平衡向右移动;如果充入SO3,A容器保持体积不变,压强变大,SO3的转化率减小,B中充入SO3,与原平衡为等效平衡,SO3的转化率不变。
本题难度:一般
4、选择题 对于可逆反应mA(g)+nB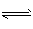 pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是? pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是?
[? ]
A.增大压强,平衡不移动,说明(m+n)一定等于(p+q)
B.升高温度,A的转化率减小,说明正反应是吸热反应
C.若增加B的量,平衡体系颜色加深,说明B必是气体物质
D.若B是气体,增加A的量,A、B转化率都一定增大
参考答案:C
本题解析:
本题难度:一般
5、选择题 可逆反应2SO2+O2?2SO3在恒温恒容下进行,能说明反应达到平衡的是( )
A.单位时间内消耗nmolSO2,同时生成nmolSO3
B.v逆(SO3)=2v正(O2)
C.容器内气体的密度保持不变
D.v(SO2)=v(SO3)
参考答案:A、单位时间内消耗n molSO2,同时生成n molSO3,表示的是正逆反应速率,但是不满足二者的化学计量数关系,说明正逆反应速率不相等,没有达到平衡状态,故A错误;
B、v逆(SO3)=2v正(O2),正逆反应速率相等,该反应达到了平衡状态,故B正确;
C、容器容积不变,气体的体积不变,反应两边都是气体,气体的总质量不变,根据ρ=mV,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故C错误;
D、v(SO2)=v(SO3),二者化学计量数相等,反应速率始终相等,无法判断正逆反应速率是否相等,故D错误;
故选B.
本题解析:
本题难度:一般
|