微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题:
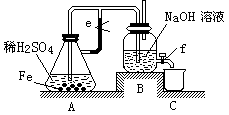
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:?,
B中可以观察到的现象是??。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是?。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是?,
有关反应的化学方程式是?。
参考答案:(1) Fe+2H+==Fe2++H2↑;有气泡冒出?(2)有白色沉淀生成
(3)白色沉淀先变成灰绿色,最后变成红褐色沉淀; 4Fe(OH)2+O2+2H2O==4Fe(OH)3
本题解析:(1)铁和稀硫酸反应生成氢气和硫酸亚铁,反应的离子方程式是Fe+2H+==Fe2++H2↑,氢气不溶于水,所以B中可以观察到的现象是有气泡冒出。
(2)由于A中的反应并没有停止,而生成的氢气的又难溶于水,所以随着反应的进行,A中的压强增大,将溶液压入B中,从而生成氢氧化亚铁白色沉淀。
(3)如果开启活塞f放掉2/3液体,则空气将进入B中。而氢氧化亚铁又极易被氧化,所以实验现象是白色沉淀先变成灰绿色,最后变成红褐色沉淀,反应的化学方程式是 4Fe(OH)2+O2+2H2O==4Fe(OH)3。
点评:氢氧化亚铁由于极易被氧化,所以该题的实验原理是利用生成的氢气将装置中的空气派出,从而可以很明显的看到白色的氢氧化亚铁的生成,且颜色能保持较长的时间。
本题难度:一般
2、选择题 在O2中灼烧0.44g硫和铁组成的化合物,使其中的硫全部变为SO2,把这些SO2全部转化为H2SO4,这些H2SO4可以用20mL0.5 mol/L的NaOH溶液完全中和,则原化合物的化学式为?
A.FeS
B.FeS
C.Fe2S3
D.Fe3S4
参考答案:B
本题解析:根据转化过程中,硫原子守恒:S~H2SO4~2NaOH可
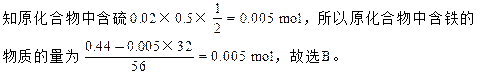
本题难度:一般
3、计算题 试简述在FeSO4溶液中加入NaOH溶液的现象,并写出有关反应的化学方程式。
参考答案:产生白色絮状沉淀,然后迅速变成灰绿色,最终变为红褐色沉淀:
FeSO4+2NaOH===Fe(OH)2↓+Na2SO4? 4Fe(OH)2+O2+2H2O===4Fe(OH)3
本题解析:本题能力层次为B。Fe(OH)2容易被氧化成 Fe(OH)3,要记住特征的颜色变化。答案是:产生白色絮状沉淀,然后迅速变成灰绿色,最终变为红褐色沉淀:
FeSO4+2NaOH===Fe(OH)2↓+Na2SO4? 4Fe(OH)2+O2+2H2O===4Fe(OH)3
学法指导:为了更好地看清楚Fe(OH)2颜色状态,做实验时:①FeSO4溶液、NaOH溶液是新配制,且用冷开水配制,可减少O2溶入量。②FeSO4溶液中加铁钉防止Fe2+氧化成Fe3+。③用长的胶头滴管吸取NaOH溶液,然后插入FeSO4溶液液面下缓慢挤压滴出。
本题难度:简单
4、选择题 把表面有氧化物的铜片和铁片一起放入盐酸中充分反应,在该溶液中的金属离子是
A.只有Fe2+
B.Fe3+和Cu2+
C.Fe2+和Cu2+
D.Fe3+和Fe2+
参考答案:A
本题解析:略
本题难度:一般
5、实验题 孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实
验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:

(1)研磨孔雀石的目的是?。浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是??(填化学式)。
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用??(填序号):
A.酸性KMnO4溶液? B.双氧水? C.浓硝酸? D.氯水
相应的离子方程式为:?。
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离。则试剂C宜选用?(填序号):
A.稀硫酸? B.NaOH溶液? C.氨水? D.CuO
固体C的化学式为?。
(4)1 mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5 mol金属铜,则该反应的化学方程式为?。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3 mol/L,必需将溶液调节至pH=?。
参考答案:(1)(共4分)增大固体表面积(1分),以增大反应速率(1分)[类似意思均可]?
SiO2(2分)
(2)(共4分)B(2分)? 2Fe2++2H++H2O2=2Fe3++2H2O(2分)(未配平1分,写为化学方程式2FeSO4 + H2SO4 + H2O2 = Fe2(SO4)3 + 2H2O且正确1分)
(3)(共4分)D(2分)? Fe(OH)3(2分)
(4)(共3分)3Cu2(OH)2CO3 + 4NH3 6Cu + 3CO2 + 9H2O +2 N2(化学式1分、配平均1分,条件1分。)
6Cu + 3CO2 + 9H2O +2 N2(化学式1分、配平均1分,条件1分。)
(5)(共2分)2
本题解析:(1)研磨孔雀石的目的是为了酸溶速率更快,所以答案为“增大固体接触面积,加快反应速率”,酸溶过程中不溶的固体为杂质SiO2。
(2)把Fe2+转化为Fe3+ 应该加入氧化剂,且不能带入杂质离子,所以用双氧水,选B。相应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O。
(3)因为目标产品是CuSO4·5H2O晶体,所以调节pH值使铁离子沉淀应选用的试剂不能带入杂质离子,所以选用固体CuO,所以沉淀物c为Fe(OH)3 和过量的CuO。
(4)碱式碳酸铜中通入氨气后有铜单质生成,说明铜被还原,NH3做还原剂。因为1mol氨气还原得到1.5mol铜单质,根据铜+2→0价,可知转移电子3mol,得失电子守恒,所以NH3失去电子也为3mol,所以可推测得NH3被氧化为了N2,所以可以得知其他产物还有CO2、H2O。所以列出反应物NH3+ Cu2(OH)2 CO3→Cu+ N2+CO2+H2O,然后根据氧化还原反应方程式配平得:3Cu2(OH)2CO3 + 4NH3 6Cu + 3CO2 + 9H2O +2 N2 。
6Cu + 3CO2 + 9H2O +2 N2 。
(5)根据Fe(OH)3溶解平衡Fe(OH)3 (s)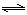 ?Fe3+ (aq)+3 OH- (aq)可得Ksp ="c(" Fe3+ ) ·c3(OH-?)= 1×10-39 ,所以把c(Fe3+)=1×10—3 mol/L带入公式中,计算得c(OH-?)= 1×10-12 ,所以c(H+?)="Kw/" c(OH-?)= 10-2 ,所以pH=2。
?Fe3+ (aq)+3 OH- (aq)可得Ksp ="c(" Fe3+ ) ·c3(OH-?)= 1×10-39 ,所以把c(Fe3+)=1×10—3 mol/L带入公式中,计算得c(OH-?)= 1×10-12 ,所以c(H+?)="Kw/" c(OH-?)= 10-2 ,所以pH=2。
本题难度:一般