微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
A.锌粉
B.镁粉
C.铁粉
D.铝粉
参考答案:C
本题解析:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。A、锌的金属性强于铁和铜的,因此锌能置换出铁和铜,得不到硫酸亚铁,A不正确;B、镁的金属性强于铁和铜的,因此镁能置换出铁和铜,得不到硫酸亚铁,B不正确;C、铁能和硫酸铜反应生成硫酸亚铁、铜,与硫酸铁反应生成硫酸亚铁,因此可以达到除杂的目的,C正确;D、铝的金属性强于铁和铜的,因此铝能置换出铁和铜,得不到硫酸亚铁,D不正确,答案选C。
本题难度:简单
2、实验题 (12分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平,不考虑2NO2?N2O4)。
(1)硝酸在该反应中体现的性质是________。
(2)0.004 mol Cu被硝酸完全溶解后,Cu失去的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________;所得溶液(假设溶质不扩散)的物质的量浓度是________。
(3)如果参加反应的Cu和HNO3的物质的量之比是3∶10,写出并配平该反应的离子方程式______________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________________________。
参考答案:(1)氧化性、酸性
(2)0.008NA(答0.008 mol不得分) 0.012 mol 44.8 mL 1/22.4 mol·L-1(或0.044 6 mol·L-1)
(3)3Cu+10H++4NO===3Cu2++NO↑+3NO2↑+5H2O?
(4)该反应含有两个氧化还原反应,两者的比例和氧化剂的用量都可以发生变化
本题解析:铜与浓、稀硝酸反应时,遵循电子守恒和氮元素的原子守恒,硝酸的作用为氧化剂和酸,HNO3还原产物不论是NO2,还是NO,或者两者的混合物,电子均来自铜,即:n(NO2)+3n(NO)=2n(Cu)。若将等物质的量的NO和NO2的混合气体倒置于水中,再通入O2后无气体剩余,发生的反应相当于NO+NO2+O2+H2O===2HNO3,即可求得溶液浓度。
本题难度:一般
3、填空题 (16分)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物(左)和“引火铁”(右)。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热 设备等在图中均已略去)。
设备等在图中均已略去)。
填写下列空白:
⑴实验进行时试管A中应加入的试剂是______;
烧瓶B的作用是____________________;
在试管D中收集得到的是_______________。
⑵实验时,U型管G中应加入的试剂是____________;
长颈漏斗H中应加入___________。
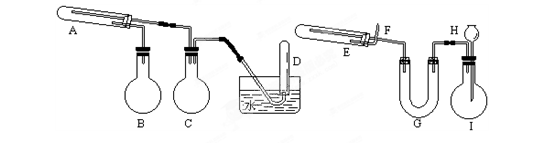 ⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________。
⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________。
⑷试管E中发生反应的化学方程式是_______________。
⑸为了安全,在E管中的反应发生前,在F 出口处必须_____________________。
出口处必须_____________________。
参考答案:

本题解析:略
本题难度:一般
4、填空题 (9分)、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)、配平下列化学方程式(并解答对应问题):
?KMnO4+?HCl==?KCl+?MnCl2+?Cl2↑+?H2O
氧化剂??还原剂?
参考答案:(9分)(1)32
(2)2Fe3++Cu=2Fe2++Cu2+? Fe(其他合理答案也给分)
(3)2、16、2、2、5、8?KMnO4?HCl
本题解析:(1)在反应中氧气是氧化剂,所以转移电子的物质的量是8×4=32mol。
(2)氯化铁和铜单质反应的方程式是2Fe3++Cu=2Fe2++Cu2+。要得到金属铜,则还需要加入还原剂铁。
(3)根据方程式可知,高锰酸钾中锰元素的化合价从+7价降低到+2价,得到5个电子,作氧化剂;氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,作还原剂。所以根据电子的得失守恒可知,配平后的计量数依次是2、16、2、2、5、8。
本题难度:一般
5、实验题 草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有?。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1:?;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
实验步骤
| 实验现象
| 实验结论
|
步骤1:向试管中加入少量固体产物,再加入足量?,充分振荡。
| 若溶液颜色明显改变,
且有红色固体生成。
| 有Fe存在。
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。
| ?
| ?
|
步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液,?
?。
| ?
?。
| 有FeO存在。
|
?
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为?(写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式?。
参考答案:(1)CO、CO2(共2分;答对1个给1分)
(2)【提出假设】Fe或铁(共1分)
【实验方案】
实验步骤
实验现象
步骤1:CuSO4溶液(共1分)
?
步骤3:滴加适量氯水,充分振荡后滴加KSCN溶液(共2分;加“氯水”和“KSCN溶液”各给1分,顺序可以颠倒)
溶液呈红色(共1分;实验操作颠倒,注意对应现象不同)
?
【反思提升】FeO+CO Fe+CO2
Fe+CO2
(3)FeC2O4 FeO+CO↑+CO2↑ (共2分)
FeO+CO↑+CO2↑ (共2分)
本题解析:(1)澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成,说明草酸亚铁分解的气体产物中含有CO2、CO;则碳元素既由+3价升高到+4价,又由+3价降低到+2价,由此可知FeC2O4 FeO+CO↑+CO2↑;(2)由于CO具有强还原性,可能将FeO还原为Fe,即FeO+CO
FeO+CO↑+CO2↑;(2)由于CO具有强还原性,可能将FeO还原为Fe,即FeO+CO Fe+CO2,则猜想1为铁或Fe;(3)由限选的已知试剂和实验现象逆推,步骤1的反应为Fe+CuSO4=FeSO4+Cu;FeO+2HCl=FeCl2+H2O,FeCl2遇KSCN溶液不变红,但氯水能将其氧化为FeCl3,FeCl3遇KSCN变红;(3)略。
Fe+CO2,则猜想1为铁或Fe;(3)由限选的已知试剂和实验现象逆推,步骤1的反应为Fe+CuSO4=FeSO4+Cu;FeO+2HCl=FeCl2+H2O,FeCl2遇KSCN溶液不变红,但氯水能将其氧化为FeCl3,FeCl3遇KSCN变红;(3)略。
本题难度:一般