微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
C
| Si
| Mn
| P
| S
|
4.070%
| 2.900%
| 0.495%
| 0.165%
| 0.010%
|
(1)称取100.000g A经过一系列处理(最后一步是在空气中灼烧)后,锰全部转变为某种氧化物,其质量为0.687g,则其化学式为?。
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数至少是?%。
(3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮。将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢?吨。
(4)某炼钢厂的烟尘成分和质量分数如下表:
?
| FeO
| Fe2O3
| CaO
|
烟尘煅烧前(%)
| 86.40
| 4.00
| 9.60
|
?
为了减少烟尘的排放,将烟尘与CO混合后在空气中煅烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,若铁的氧化物中只有两种物质组成,则铁的氧化物的组成和物质的量之比如何?
参考答案:(1)Mn3O4(2分)
(2) 27.46
(3)132.701(3分)
(4)反应后固体混合物中 n(Fe):n(O)=1:1.4
①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;
②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;
本题解析:(1)100.000g A含有Mn的质量=100.000g×0.495%=0.495g,所得MnxOY中O元素的质量=0.687g-0.495g=0.192g,则:x:y="0.495/55" :0.192/16=3:4,故该氧化物的化学式为Mn3O4,故答案为:Mn3O4;
(2)将Ca(H2PO4)2改写CaH4O3?P2O5,含P2O5的质量分数═45.25%×142/234=27.46%,普钙中还可能还有Ca3(PO4)2,所以用P2O5表示的质量分数还可能大于27.46%,故P2O5的质量分数≥27.46%,故答案为:≥27.46%;
(3)令可以生成高锰钢y吨,根据Fe元素质量不变,则:y×(1-30%-0.4%)=100×(1-4.070%-2.9%-0.495%-0.165%-0.010%)解得:y=132.701,故答案为:132.701;
(4)假设烟尘煅烧前烟尘的质量为100g,则n(FeO)=1.2mol,n(Fe2O3)=0.025mol,Fe元素物质的量=1.2mol+0.05mol=1.25mol,其质量=1.25mol×56g/mol=70g,烟尘煅烧前后Fe元素的质量不变.煅烧后CaO的质量也不变,煅烧后物质的质量=100*9.6%/8.92%=107.6g,其中O元素的质量=107.6g×(1-8.92%)-70g=28.0g,n(O)=28/16=1.75mol,反应后固体混合物中?n(Fe):n(O)=1.25mol:1.75mol=1:1.4,故烟尘煅烧后铁的氧化物的平均组成为FeO1.4。铁的常见氧化物有FeO、Fe2O3、Fe3O4,①若是FeO和Fe2O3的混合物,令FeO和Fe2O3的分别为xmol、ymol,则(X+3Y)/(X+2Y)=1.4,整理得x:y=1:2,故FeO和Fe2O3的物质的量之比为1:2;②若是Fe3O4和Fe2O3的混合物,令Fe3O4和Fe2O3的xmol、ymol,则(4X+3Y)/(3X+2Y)=1.4,整理得x:y=1:1,故Fe3O4和Fe2O3的物质的量之比为1:1;③若是FeO和Fe3O4的混合物,不符合平均组成,不合理;④若是FeO、Fe2O3和Fe3O4的混合物,利用极限法判断,若FeO和Fe2O3的混合物,Fe2O3的含量最高为2/3=66.7%,若为Fe3O4和Fe2O3的混合物,Fe2O3的含量最低为1/2=50%,故50%<Fe2O3的物质的量分数<66.7%,答:①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;③若是FeO和Fe3O4的混合物,不合理;④若是FeO、Fe2O3和Fe3O4的混合物,50%<Fe2O3的物质的量分数<66.7%。
本题难度:一般
2、选择题 往2支分别装有浅绿色的Fe(NO3)2和FeSO4溶液的试管中,逐滴加入稀盐酸时,溶液的颜色变化应该是
A.前者基本没有改变、后者变棕黄色
B.前者变棕黄色、后者也变棕黄色
C.前者变棕黄色、后者基本没有改变
D.前者、后者都基本没有改变
参考答案:C
本题解析:当向装有浅绿色的Fe(NO3)2溶液的试管中,逐滴加入稀盐酸时,发生反应:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,产生了Fe3+,所以溶液变为黄色;而当向装有浅绿色的FeSO4溶液的试管中,逐滴加入稀盐酸时,不会发生任何反应。所以溶液的颜色基本不变。因此选项为C。3-在酸性条件下发生的反应及溶液的颜色的变化的知识。
本题难度:一般
3、选择题 为鉴定某盐成分,选用如下方法:下列结论正确的是( )
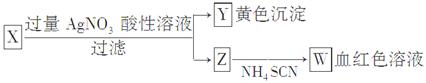
A.Z中一定有Fe3+
B.X中一定有Fe2+
C.Y为AgBr沉淀
D.X一定为FeBr2
参考答案:A
本题解析:本题以框图推断的形式考查学生的分析推理能力。若X中含有Fe2+,可被H+、NO3-氧化生成Fe3+,故X中至少含有Fe2+或Fe3+中的一种,因Fe3+与SCN-反应生成血红色溶液是Fe3+的特征反应,故Z中一定有Fe3+。AgBr为浅黄色沉淀。
本题难度:一般
4、选择题 为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
A.通入氯气
B.加入Zn
C.加入Fe
D.加入Cu
参考答案:C
本题解析:除杂的前提是加入试剂不能与FeCl2反应,排除AB:2FeCl2+Cl2=2FeCl3? Zn+FeCl2=ZnCl2+Fe;
再者是不能引入杂质离子,排除D:Cu+2FeCl3=CuCl2+2FeCl2
故答案为C:2FeCl3+Fe=3FeCl2
本题难度:一般
5、填空题 (12分)工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:

(1)在废渣溶解时需要使用酸,应选用__________,为了提高废渣的浸取率,可采用的措施有哪些?
_____________________________________________________________(至少写出两点)。
(2)物质A是一种氧化剂,工业上最好选用_____________(供选择使用的有:空气、Cl2、MnO2),其理由是?(至少写出两点)。
(3)“结晶”反应的化学方程式为__________________________________________________。
(4)上述生产流程中多处采用了过滤操作,实验室中完成相应的操作需要用到的玻璃仪器有烧杯及____________________________________________。
参考答案:(1)硫酸,将废渣粉碎、加热、搅拌等。?
(2)空气,原料来源容易、成本低、不产生污染、不引入杂质。
(3)3Fe2(SO4)3+12NH3·H2O=(NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4。
(4)玻璃棒、漏斗。
本题解析:通过流程图可以看出生成的是硫酸盐,所以溶解废渣时要用硫酸。从影响速率的因素考虑应该采用废渣粉碎、加热、搅拌等方法。空气是一种最廉价且无污染的氧化剂,所以选空气。根据图示可知,结晶过程发生的反应为3Fe2(SO4)3+12NH3·H2O=(NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4。过滤操作总需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
点评:近几年,工艺流程题已成为各地高考的热点试题,其具有阅读量大、信息新颖、情境陌生、流程复杂等特点。考生对此往往就会有畏惧感,解题时不知从何处入手突破,所以这类试题的得分率一般不是很高。但细细研究近几年各地高考工艺流程题,不难发现这些试题考查的知识都源于书本而高于书本,如果解题方法得当,还是可以获得高分。
本题难度:一般