微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 图(1)是NaCl的晶体结构。在NaCl的晶体结构中,钠离子和氯离子可以被看成是不等径的刚性网球,并彼此相切如图(2)。离子键的键长是相邻阴、阳离子的半径之和如图(3),已知a为常数。
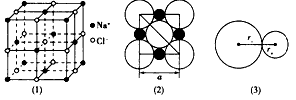
试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引_______个Cl-,Na+数目与C1-数目之比为_____。
(2)Na+半径与Cl-半径之比为r+:r-=_______(已知 = 1.414,=1.732,=2.236)。
(3)NaCI晶体不存在分子,但在温度达到l 413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6 L (已折算为标准状况),则此时氯化钠气体的分子式为________。
参考答案:(1)6;1:1
(2)0.414:1
(3)Na2Cl2
本题解析:
本题难度:一般
2、选择题 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图 所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是
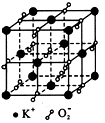
[? ]
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3:1
参考答案:AD
本题解析:
本题难度:一般
3、选择题 钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是
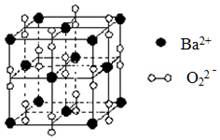
A.与每个Ba2+距离相等且最近的Ba2+共有6个
B.晶体中Ba2+的配位数为8
C.晶体的化学式为Ba2O2
D.该氧化物是含有非极性键的离子化合物
参考答案:D
本题解析:A项:利用均摊法计算,晶体中与每个Ba2+距离相等且最近的Ba2+共有8×3×(1/2) =12,故错;B项:晶体中Ba2+的配位数为6,故错;C项:晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8×(1/8) +6×(1/2) =4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×(1/4)+1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2,故错。故选D。
点评:本题考查晶胞的结构和计算的知识,题目具有一定难度,学生需要注意的是做题时注意利用均摊法计算。
本题难度:一般
4、选择题 由下列三种元素构成的化合物中既有离子晶体,又有分子晶体的是
A.H、O、C
B.Na、S、O
C.H、N、O
D.H、S、O
参考答案:C
本题解析:离子间通过离子键形成的晶体是离子晶体,分子间通过分子间作用力形成的晶体是分子晶体,所以A和D中只能形成分子晶体,B中只能是离子晶体,C可以形成离子晶体,例如硝酸铵,也可以是分子晶体,例如硝酸,答案选C。
本题难度:简单
5、选择题 某物质熔融状态可导电,固态可导电,将其投入水中水溶液也可导电,则可推测该物质可能是?(?)
A.金属晶体
B.分子晶体
C.原子晶体
D.离子晶体
参考答案:A
本题解析:固体状态能导电的在上面的选项中只有金属晶体,至于在水溶液里也能导电,有可能是金属与水反应后生成的电解质溶液导电。所以答案选A。
本题难度:简单