微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验原理、装置、操作或结论的描述中,不正确的是
[? ]
A.实验室用大理石与稀盐酸制CO2
B.萃取碘水中的碘
C.制取SO2、检验SO2的漂白性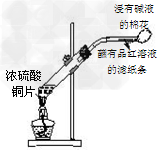
D.实验室用乙醇和浓硫酸制乙烯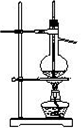
参考答案:B
本题解析:
本题难度:一般
2、简答题 如图是实验室制氨气的装置图,请回答:
①写出实验室制取氨气的化学反应方程式:______
②收集氨气用______法,
③干燥氨气可选用______
④如何检验氨气是否收集满:______
⑤实验装置中棉花的作用是:______.
参考答案:①实验室用氯化铵和碱石灰反应制取氨气,即碱与盐反应生成新碱和新盐,化学方程式为:2NH4Cl+Ca(OH)2

CaCl2+2NH3↑+2H2O.
故答案为:2NH4Cl+Ca(OH)2

CaCl2+2NH3↑+2H2O;
②应为氨气的密度比空气的密度小,所以要用向下排空气法收集氨气.故答案为:向下排空气法;
③反应过程中会产生水,使氨气中混有水蒸气,可用碱石灰吸收水蒸气,但是不能用氯化钙和无水硫酸铜,因为它们均与氨气反应.故答案为:碱石灰;
④检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”.
故答案为:使湿润的红色石蕊试纸变蓝(合理答案均可);
⑤在收集氨气时氨气温度比空气温度高,收集的氨气的浓度小,容易逸出,因此在瓶口塞一团棉花,目的是防止氨气逸出,污染环境,一般利用浸有稀硫酸的棉花团堵住试管口,
故答案为:氨气逸出,污染环境.
本题解析:
本题难度:一般
3、实验题 在实验室中可用如下图所示的装置来制取干燥的氨气
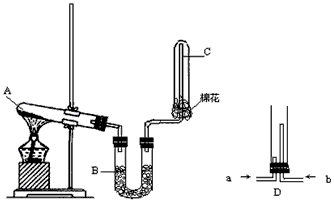
(1)写出A中发生反应的化学方程式:_________________________________
(2)氨分子的结构呈___________形,U形管B中所放的药品名称是______________________
(3)试管C的管口处要放置一小团棉花,放置棉花的作用是______________________
(4)资料显示:“氨气可在纯氧中点燃,反应生成氮气和水”
为验证此事实,某同学设计了一个实验方案:将从U形管B出来的氨气与纯净的氧气(氧气已预先制好)分别通入装置D,然后在装置D内点燃气体。你认为该方案是否合理?____________(填“合理”和“不合理”)如果你认为不合理,则不需要回答后面的问题,如果你认为合理,请回答:
①两种气体应分别从哪支导管通入?______________
②通入气体的先后顺序是:先通入___________,后通入__________,理由是_____________________。
参考答案:(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)三角锥;碱石灰
(3)使收集到的NH3更纯净
(4)合理;①O2从a管通入,NH3从b管通入;②O2;NH3;O2的密度比空气大,NH3的密度比空气小,先通入O2后通入NH3是为了使NH3在纯氧中点燃。
本题解析:
本题难度:一般
4、简答题 甲、乙、丙三位同学分别用如下甲、乙、丙三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
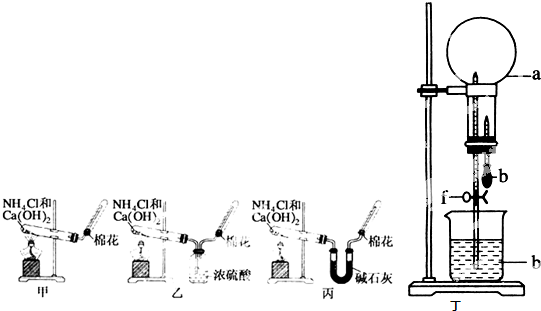
(1)三位同学制取氨气的化学方程式为:______.
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是______
A.氨气难溶于水 B.氨气极易溶于水
C.氨气密度比空气大D.氨气密度比空气小
E.氨气密度比水大F.氨气密度比水小
(3)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨气,收集不到氨气的主要原因是______(用化学方程式表示).
(4)检验氨气是否收集满的方法是______.
A.闻到有氨气逸出
B.棉花被气体冲出
C.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是______(填“甲”、“乙”或“丙”).
(6)要得到干燥的氨气可选用______作干燥剂.
A.碱石灰(CaO和NaOH的混合物)
B.浓硫酸
C.浓硝酸
D.氢氧化钠溶液
(7)用如图丁装置进行喷泉实验,烧瓶中已装满干燥氨气(标准状况),引发水向上喷的操作是______.
参考答案:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2△.CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2△.CaCl2+2NH3↑+2H2O;
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,
故选:BD;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,反应方程式为:2NH3+H2SO4=(NH4)2SO4,故答案为:2NH3+H2SO4=(NH4)2SO4;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,故选:C;
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到,故答案为:丙;
(6)氨气是碱性气体所以能溶于酸,则氨气不能用酸干燥,氨气极易溶于水,所以氨气不能用水溶液干燥,故选A;
(7)打开止水夹,挤出胶头滴管中的水,氨气极易溶于水而使烧瓶内压强迅速减小,外界大气压不变,导致大气压大于烧瓶内压强,烧杯内水通过玻璃管进入烧瓶,从而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水.
本题解析:
本题难度:一般
5、简答题 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)______;
①稀硫酸溶液;?②浓盐酸;?③石灰石;④碳酸钠粉末;⑤Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式______;
(2)甲同学所做实验图1烧杯中现象为______;
(3)乙同学所做实验图2中B处的现象为______;
(4)写出图2中A处发生反应的离子方程式:______.
参考答案:(1)①验证元素非金属性与对应最高价含氧酸之间的关系,圆底烧瓶内的固体药品应为大理石,不能用碳酸钠粉末,反应剧烈,不易控制反应,所选取的酸应为稀硝酸,不能选硫酸,硫酸钙微溶,阻止碳酸钙与硫酸进一步反应.
所以烧瓶中应是碳酸钙与稀硝酸反应,因为碳酸钙难溶于水,要写分子式,硝酸是强酸,要写成离子,因此烧瓶中反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
故答案为:①、④;CaCO3+2H+=Ca2++CO2↑+H2O?
(2)C中应盛装硅酸钠溶液,以此来证明硝酸、碳酸以及硅酸的酸性强弱,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,因此烧杯中反应的离子方程式是CO2+SiO32-+H2O=H2SiO3↓+CO32-,H2SiO3是白色沉淀.
故答案为:出现白色沉淀
(3)单质的氧化性Cl2>Br2>I2,则B处氯气通过湿润的淀粉KI试纸,氯气与KI反应Cl2+2KI═2Cl-+I2,生成碘单质,碘遇淀粉变蓝色.
故答案为:湿润的淀粉KI试纸变蓝?
(4)单质的氧化性Cl2>Br2>I2,A处氯气通过沾有NaBr溶液的棉花溴化钠溶液,发生置换反应生成溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-
本题解析:
本题难度:一般