微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
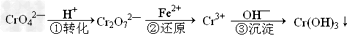
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显________色.
(2)能说明第①步反应达平衡状态的是_____________。
a.Cr2O72-和CrO42-的浓度相同?
b.2v?(Cr2O72-)?=v?(CrO42-)
c.溶液的颜色不变?
d.溶液的pH值不变
(3)第②步中,还原0.01mol?Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+?+?CrO2-(亮绿色)?+?H2O Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)?+?3OH-。下列有关说法中正确的是__________
Cr3+(紫色)?+?3OH-。下列有关说法中正确的是__________
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b、在一定条件下存在:Cr(OH)3?+?OH-?→?CrO2-?+?2H2O?;Cr(OH)3?+?3H+?→?Cr3+?+?3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
参考答案:(1)橙
(2)cd
(3)0.06?
(3)ab
本题解析:
本题难度:一般
2、选择题 己知反应A(g) + B(g)  C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃
| 700
| 830
| 1200
|
K值
| 1.7
| 1.0
| 0.4
|
?
A.达到平衡后,B的转化率为50%
B.增大压强,正、逆反应速率均加快
C.该反应为吸热反应,升高温度,平衡正向移动
D.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1
参考答案:C
本题解析:设平衡时参加反应的B的物质的量为xmol,则:
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
开始(mol·L-1):0.2? 0.2? 0? 0
变化(mol·L-1):x? x? x? x
平衡(mol·L-1):0.2-x? 0.2-x? x? x
故 ?=1,解得x=0.1
?=1,解得x=0.1
所以平衡时B的转化率为 ×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)=
×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)=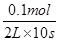 =0.005mol·L-1·s-1,故D正确,故选C。
=0.005mol·L-1·s-1,故D正确,故选C。
本题难度:一般
3、选择题 下图表示可逆反应mA(g)+nB(g)? pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
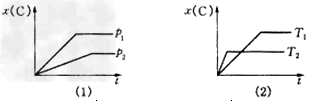
[? ]
A.放热反应,m+n>p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.吸热反应,m+n=p
参考答案:A
本题解析:
本题难度:一般
4、简答题 原创工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)

CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250°C | 300°C | 350°C
K
2.041
0.270
0.012
|
①由表中数据判断△H______0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.
(2)在100℃压强为0.1MPa条件下,容积为V?L某密闭容器中a?mol?CO与?2a?mol?H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的平衡常数K=______(用含a、V的代数式表示并化简至最简单的形式).此时保持温度容积不变,再向容器中充入a?mol?CH3OH(g),平衡______(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数______.(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是______.
A.升温? B.加入催化剂? C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体?F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)______.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙
|
反应物投入量
1molCO、2moL?H2
1molCH3OH
2molCH3OH
|
平
衡
时
的
数
据
CH3OH浓度(mol/L)
c1
c2
c3
反应的能量变化
akJ
bkJ
ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
|
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为______
A?c3>2c1?B?c1<c3<2c1?C?c1=c2
②a、b、c的关系表达正确的为______
A?c<2|△H|B?a+b=|△H|C?c=2b
③p1、p2、p3的关系不正确的为______
A?p1=p2?B?p2<p3<2p2?C?p3>2p2
④a1、a2、a3的关系表达不正确的为______
A?a1=a2?B?a3<a2?C?a1+a2=1.
参考答案:(1)①温度升高,K减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,故答案为:<;
?②达到平衡时测得c(CO)=0.2mol/L,则转化的CO的物质的量为2.0mol-0.2mol/L×1L=1.6mol,
所以CO的转化率为1.6mol2.0mol×100%=80%,则
? ?CO(g)+2H2(g)

CH3OH(g)
起始:1mol/L? 3mol/L
转化:0.8mol/L? 1.6mol/L? 0.8mol/L
平衡:0.2mol/L? 1.4mol/L?0.8mol/L
所以:k=0.8mol/L0.2mol/L×(1.4mol/L)2=2.041(mol/L)-2,温度应为250℃,
故答案为:80%;250℃;
(2)
? ? ?CO(g)+2H2(g)

CH3OH(g)
起始:aVmol/L? ?2aVmol/L? O
转化:0.5×aVmol/L? aVmol/L?0.5×aVmol/L
平衡:0.5×aVmol/L? aVmol/L?0.5×aVmol/L
k=V2a2,
再向容器中充入a?mol?CH3OH(g),生成物浓度增大,平衡向逆反应方向移动,再次达到新平衡时,虽然CO的物质的量增多,但比总物质的量的增多要小,CO的体积分数反而减小,
故答案为:V2a2;向逆反应方向;减小;
(3)A.升温,平衡向逆反应方向移动,CO的转化率的减小,故A错误;
B.加入催化剂,平衡不移动,转化率不变,故B错误;
C.增加CO的浓度,CO的转化率的减小,,故C错误;
D.恒容充入H2,平衡向正反应方向移动,转化率增大,故D正确;
E.恒压充入惰性气体,平衡不移动,转化率不变,故E错误;
F.分离出甲醇,平衡向正反应方向移动,转化率增大,故F正确.
故答案为:DF;
(4)A.无论是否达到平衡状态,生成CH3OH的速率与消耗CO的速率相等,故A错误;
B.无论是否达到平衡状态,气体的质量不变,容器的体积不变,则混合气体的密度不变,故B错误;
C.混合气体的相对平均分子质量不变,说明反应达到平衡状态,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,说明反应达到平衡状态,故D正确.
故答案为:CD;
(5)甲乙为等效平衡,则有:c1=c2、a1=a2、a+b=|△H|、p1=p2;
甲丙相比较,相当于在甲的基础上压缩容器体积,则平衡向正反应方向移动,
则有:c3>2c1、c<2|△H|、p2<p3<2p2、a3<a2,
故答案为:AC;AB;C;A.
本题解析:
本题难度:一般
5、简答题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)
已知该反应平衡常数(K)与温度(T)的关系如图所示.
(1)一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______(选填编号).
a.c(H2)与c(H2O)的比值保持不变? b.单位时间内有2mol?H2消耗时有1mol?H2O生成
c.容器中气体密度不再改变? d.容器中气体压强不再改变
(2)温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将______(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将______.
(3)一定温度和压强下,往体积为20L的容器中通入一定物质的量的H2与CO2,达到平衡时,容器中含有0.1mol二甲醚.计算H2的平均反应速率:______(用字母表示所缺少的物理量并指明其含义).
(4)工业上为提高CO2的转化率,采取方法可以是______(选填编号).
a.使用高效催化剂? ?b.增大体系压强
c.及时除去生成的H2O? d.增加原料气中CO2的比例.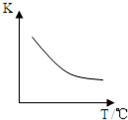
参考答案:(1)a.c(H2)与c(H2O)的比值保持不变时,说明该反应达到平衡状态,故正确;
b.无论反应是否达到平衡状态,单位时间内有2mol?H2消耗时有1mol?H2O生成,所以不能说明该反应达到平衡状态,故错误;
c.混合物的质量不变,容器的体积不变,所以无论反应是否达到平衡状态,容器中气体密度始终不变,故错误;
d.该反应是一个反应前后气体体积减小的可逆反应,当容器中气体压强不再改变时,该反应达到平衡状态,故正确;
故选ad;
(2)根据温度和K之间的关系图知,当升高温度时,K减小,说明该反应向逆反应方向移动,则二甲醚产率减小,平衡向逆反应方向移动,则气体的物质的量增大,质量不变,则其平均摩尔质量减小,所以其平均式量减小,故答案为:变小;变小;
(3)根据v=△c△t知,二甲醚的平均反应速率=0.1mol20Lt=0.005tmol/(L.s),根据二甲醚和氢气的关系式知,氢气的平均反应速率═0.005tmol/(L.s)×6=0.03tmol/(L.s),t-达到平衡所需的时间(单位:s,可自定),
故答案为:0.03tmol/(L.s),t-达到平衡所需的时间(单位:s,可自定);
(4)a.使用高效催化剂只改变反应速率不影响化学平衡移动,故错误;?
b.该反应是一个反应前后气体体积减小的可逆反应,增大体系压强平衡向正反应方向移动,所以能提高二氧化碳的转化率,故正确;
c.及时除去生成的H2O,平衡向正反应方向移动,所以能提高二氧化碳的转化率,故正确;?
d.增加原料气中CO2的比例,平衡向正反应方向移动,但二氧化碳的转化率减小,故错误;
故选bc.
本题解析:
本题难度:一般