微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为____________
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____________________
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式______
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
__________
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =_______
kJ/mol(注:题中所设单质均为最稳定单质)
参考答案:(1)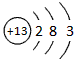
(2)弱于
(3)S + 2H2SO4(浓)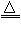 3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4)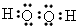 ?
?
(5)NaNO2
(6)(3a-4b)KJ/mol
本题解析:
本题难度:一般
2、选择题 下列有关推断中不符合实际的是( )
A.第n周期第n主族的元素不一定是非金属元素
B.第n周期第n主族(n>1)的元素一定是金属元素
C.第n周期有(8-n)种非金属元素(n>1,包括稀有气体元素)
D.第n周期中有2n2种元素
参考答案:A.第一周期第ⅠA族的元素为H,属于非金属元素,第三周期ⅢA元素为Al,属于金属元素,故A正确;
B.除第一周期外,由元素在周期表位置可知,第n周期第n主族的元素为金属元素,故B正确;
C.第二周期含有6种非金属元素,第三周期含有5种非金属元素,第四周期含有4种非金属元素,第五周期含有3种非金属元素,第六周期含有2种非金属元素,第七周期含有1种非金属元素,则第n周期有(8-n)种非金属元素(n>1,包括稀有气体元素),故C正确;
D.第三周期中含有8种元素,长周期中都不符合第n周期中有2n2种元素,故D错误;
故选D.
本题解析:
本题难度:一般
3、选择题 下列元素均位于第VIIA族,其中非金属性最弱的元素是
A.F
B.Cl
C.Br
D.I
参考答案:D
本题解析:试题分析:同主族自上而下,非金属性逐渐降低,所以非金属性最弱的元素是I,答案选D。
考点:考查元素周期律的应用
点评:该题是基础性试题的考查,试题基础性强,侧重考查学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力。
本题难度:一般
4、推断题 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次为_____________、_____________;
(2)XZ2与YZ2分子的立体结构分别是____________和__________,相同条件下两者在水中的溶解度较大的是___________(写分子式),理由是________________;
(3)Q的元素符号是_________,它属于第_________周期,它的核外电子排布式为__________,在形成化合物时它的最高化合价为___________;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键____________。
参考答案:(1)S ;C
(2)V形 ;线形 ;SO2 ;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr ;四 ;1s22s22p63s23p63d54s1?; +6
(4)F-H…F?,?F-H…O?,?O-H…F?,?O-H…
本题解析:
本题难度:一般
5、简答题 实验题:
某化学兴趣小组做了如下三个实验:
实验A:集气瓶中放青色、未熟的水果(蔬菜),盖上玻璃片;
实验B:集气瓶中放青色、未熟的水果(蔬菜),通入一定量的乙烯;
实验C:集气瓶中放青色、未熟的水果(蔬菜),瓶底放少量KMnO4固体,盖上玻璃片.
请根据所学化学知识完成下列问题:
(1)预期实验结果:水果成熟的先后顺序是______(用序号填写)
(2)解释你的预期结果的原因______.
为探究?Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中;
2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液;
3将一小段镁带投入稀盐酸中;
4将一小片铝投入稀盐酸中.
实验现象
A剧烈反应,迅速生成大量的气体
B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红
C反应不剧烈,产生无色气体
D有气体产生,溶液变成红色
|
(1)请在下表中填写与实验步骤对应的实验现象序号:
(2)请写出钠与水反应的方程式______.
(3)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左到右核电荷数逐渐增多,原子半径逐渐______,失电子能力逐渐______,因此______性逐渐减弱.
参考答案:I、(1)乙烯可以做水果催熟剂,而高锰酸钾固体能和乙烯反应,故答案为:BAC;
(2)乙烯可以做水果催熟剂,而高锰酸钾固体能和乙烯反应,因此B中水果最先熟,而C中水果最后熟,
故答案为:乙烯可以做水果催熟剂,而高锰酸钾固体能和乙烯反应,因此B中水果最先熟,而C中水果最后熟;
II:(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,和水以及酸反应的现象可以根据此来回答,故答案为:实验步骤1234实验现象BDAC(2)金属钠和水反应生成氢氧化钠和氢气,即2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)同周期元素从左到右核电荷数逐渐增多,原子半径逐渐减小,失电子能力逐渐减弱,金属性逐渐减弱,故答案为:减小,减弱,金属.
本题解析:
本题难度:一般