|
高考化学必考知识点《有关氧化还原反应的计算》试题巩固(2017年最新版)(二)
2017-08-01 02:10:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应说法不正确的是
A.Na2O2在反应中既作氧化剂又作还原剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2 mol FeSO4发生反应时,共有12 mol电子转移
|
参考答案:D
本题解析:6份的Na2O2中只有1份中的氧失去电子变成氧气,另外5份中的氧得到电子变成-2价的氧,A项错;2 mol Fe2+转化为+6价的铁时,转移8 mol电子,再加上生成1 mol O2时Na2O2失去的2 mol电子,反应中共转移10 mol电子,D错误。答案选D。
考点:氧化还原反应
本题难度:一般
2、填空题 写出下列反应的化学方程式,并注明反应类型:
①溴乙烷制取乙烯______;______.
②苯酚和浓溴水反应______;______.
③乙醛和新制Cu(OH)2的反应______;______.
参考答案:①溴乙烷在浓硫酸作用下加热发生消去反应生成乙烯和溴化氢,反应的化学方程式为:CH3CH2Br浓硫酸
本题解析:
本题难度:一般
3、选择题 下列表达方式错误的是
A.氟化钠的电子式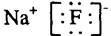
B.氯原子的结构示意图: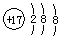
C.CO2分子的结构式:O=C=O
D.甲烷的电子式
参考答案:B
本题解析:氟化钠是离子化合物,A正确;B不正确,氯原子的最外层电子数是7个;CO2和甲烷都是共价化合物,含有极性键,C、D正确,答案选B。
点评:该题是高考中的常见题型与重要的考点,属于中等难度试题的考查。试题基础性强,主要是考查学生对常见化学用语的熟悉掌握程度,旨在考查学生灵活运用基础知识解决实际问题的能力。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住。
本题难度:一般
4、简答题 将5.0g碳酸钙放入一定量稀盐酸中恰好完全反应,得到40mL密度为1.32g/mL的溶液.试计算:
(1)生成标准状况下的二氧化碳气体多少升?(不考虑CO2在水中的溶解)
(2)所得溶液中氯化钙的物质的量浓度.
(3)所用稀盐酸的质量分数.
参考答案:(1)根据碳原子守恒得CaCO3----CO2,设二氧化碳的体积为x,
CaCO3----CO2
100g 22.4L
5.0g x
100g:22.4L=5.0g:x
x=5.0g×22.4L100g=1.12L,
答:生成标准状况下的二氧化碳气体1.12L;
(2)根据钙原子守恒得CaCO3----CaCl2,氯化钙的物质的量=5.0g100g1×1=0.05mol,氯化钙的物质的量浓度=0.05mol0.04L=1.25mol/L,
答:所得溶液中氯化钙的物质的量浓度为1.25mol/L;
(3)根据CaCO3----2HCl知,氯化氢的质量=5.0g100g/mol1×2×36.5g/mol=3.65g,二氧化碳的质量=1.12L22.4Lmol×44g/mol=2.2g,根据质量守恒定律得盐酸的质量=40mL×1.32g/mL+2.2g-5.0g=50g,则盐酸的质量分数=3.65g50g×100%=7.3%,
答:所用稀盐酸的质量分数7.3%.
本题解析:
本题难度:一般
5、选择题 下列化学用语正确的是
A.K+离子的结构示意图: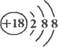
B.四氯化碳的电子式:
C.H4分子的比例模型: 
D.次氯酸的结构式: H-O-Cl
参考答案:D
本题解析:A、钾的核电荷数为19,故离子结构示意图中圆圈内的数字为19,故A错误;B、氯原子最外层电子没写出,故错误;C、该模型为球棍模型,不是比例模型,故错误;故选D。
本题难度:一般
|