微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
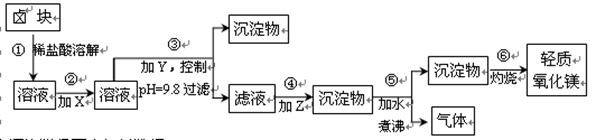
1、填空题 (16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。
查阅资料得下表相关数据:
表1: 生成氢氧化物沉淀的pH
| 表2: 原料价格表
|
物质
| 开始沉淀
| 沉淀完全
| 物质
| 价格(元/吨)
|
Fe(OH)3
| 2.7
| 3.7
| a.漂液(含25.2%NaClO)
| 450
|
Fe(OH)2
| 7.6
| ? 9.6﹡
| b.双氧水(含30%H2O2)
| 2400
|
Mn(OH)2
| 8.3
| 9.8
| c.烧碱(含98%NaOH)
| 2100
|
Mg(OH)2
| 9.6
| 11.1
| d.纯碱(含99.5%Na2CO3)
| 600
|
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的??(选填试剂编号)。
(2)步骤②发生反应的离子方程式为?;步骤⑤中发生反应的化学方程为???。
(3)步骤③控制pH=9.8的目的是???。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、?和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因?。
参考答案:(16分)
(1)a、c、d(各1分)
(2)2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;MgCO3 + H2O△Mg(OH)2+ CO2↑(各3分)
(3)使Mg2+以外的杂质尽可能彻底地转化为沉淀除去(2分)
(4)坩埚?(2分)
(5)Mg(OH)2(s) 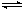 Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
本题解析:(1)流程图中加入X的目的是将亚铁离子氧化为铁离子,考虑氧化剂的价格,应该选择漂粉;加入Y的目的是调节溶液的pH,使铁离子、锰离子沉淀,碳酸钠溶液显碱性,但碱性不强,所以选择用氢氧化钠;加入Z的目的是使镁离子沉淀,所以选择碳酸钠,且加水煮沸,使生成的碳酸镁沉淀转化为氢氧化镁沉淀,成本较低,因此试剂X、Y、Z最佳选择依次是表2中的a、c、d;
(2)加入NaClO的目的是将亚铁离子氧化为铁离子,离子方程式为2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;步骤⑤是把碳酸镁沉淀转化为氢氧化镁,化学方程式为MgCO3 + H2O△Mg(OH)2+ CO2↑;
(3)根据表1中的数据可知,pH=9.8时铁离子、锰离子完全沉淀,而镁离子开始沉淀,而流程的要求是产品尽量不含杂质,所以步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去;
(4)灼烧时用到的仪器有铁三脚、酒精喷灯、坩埚和泥三角。
(5)NH4Cl溶液中的铵根离子与溶解平衡中Mg(OH)2(s) 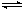 Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
本题难度:一般
2、选择题 25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,该溶液中一定不能大量存在的离子是
A.NH4+
B.HCO3-
C.SO32-
D.NO3-
参考答案:B
本题解析:分析:25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,根据离子之间不能结合生成水、气体、沉淀等,则能大量共存,以此来解答.
解答:25℃时,某物质的水溶液中由水电离出的c(H+)=1×10-12mol/L,为酸或碱溶液,
A.酸溶液中氢离子与铵根离子不反应,能共存,故A不选;
B.HCO3-既能与酸反应又能与碱反应,一定不能共存,故B选;
C.碱溶液中离子之间不反应,能共存,故C不选;
D.无论酸或碱溶液中离子之间不反应,能共存,故D不选;
故选B.
点评:本题考查离子的共存,明确习题中的信息是解答本题的关键,熟悉复分解反应发生的条件即可解答,题目难度不大.
本题难度:困难
3、填空题 现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、
Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、AlO2-、NO3-、SO42-、CO32-。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A________;D________;E________;F________。
(2)用离子方程式解释C溶液呈碱性的原因:__________________________________。
(3)写出实验③中反应的离子方程式:________________________________。
参考答案:(1)Ba(OH)2 AlCl3 KAlO2 FeSO4
(2)CO32-+H2O HCO3-+OH-
HCO3-+OH-
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
本题解析:使溶液呈碱性的阴离子有OH-、AlO2-、CO32-;根据实验②可以确定B为AgNO3,根据实验③可以确定F可能为FeCl2或者FeSO4,根据实验④可以确定D不可能含有SO42-,所以F为FeSO4,D为AlCl3。由于氢氧化铝的酸性小于碳酸氢根的,所以偏铝酸盐的碱性强于碳酸盐的,结合碱性A>E>C,可以确定A为Ba(OH)2,E为KAlO2,C为Na2CO3,C溶液呈碱性的原因:CO32-+H2O HCO3-+OH-,实验③中反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
HCO3-+OH-,实验③中反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。
本题难度:一般
4、选择题 下列化合物中,不能发生消去反应的是
A.CH3CH2OH
B.CH3CH2Cl
C.(CH3)2CHBr
D.(CH3)3C-CH2Br
参考答案:D
本题解析:消去反应是指在一定条件下,有机物分子内脱去一个或几个小分子生成分子中含有双键的或叁键等不饱和有机物的反应。消去反应分为两种,一种是含有羟基的物质,羟基和相邻碳原子上的氢,在浓硫酸加热170℃的条件下,脱去一个水生成一个双键和水分子。一种是卤代烃,在氢氧化钠醇溶液加热条件下,卤素原子和相邻碳原子上的氢脱去,生成卤化氢和双键。消去反应具备的条件为:分子中至少两个碳,且相邻的C上一定要有氢:
本题难度:困难
5、选择题 下列各组离子,加入盐酸或NaOH溶液都能大量共存的是
A.Al3+、K+、AlO2-、Cl-
B.Ba2+、Na+、Cl-、SO42-
C.Na+、Cl-、SO42-、I-
D.Na+、K+、Ag+、NO3-
参考答案:C
本题解析:
本题难度:困难