微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g);△H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图的曲线图:
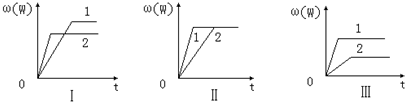
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析正确的是( )
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0
参考答案:AC
本题解析:
本题难度:简单
2、填空题 (普通班做)
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
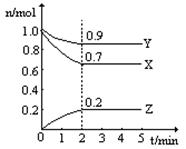
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
平衡时,X的转化率为 ;平衡时,Y的浓度为 ;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A容器内压强不再发生变化
B X的体积分数不再发生变化
C容器内气体原子总数不再发生变化
D相同时间内消耗2n mol的Z的同时消耗n mol的Y
E. 相同时间内消耗n mol的Y的同时消耗3n mol的X
参考答案:18、(1)3X+Y?2Z (2)0.05mol?L-1?min-1 30% 4.5mol/L (3)ABD
本题解析:(1)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,该反应的化学方程式为为:3X+Y?2Z;(2)v(Z)=△C/△t=0.2/2x2=0.05mol?L-1?min-1,从开始至2min,Z的平均反应速率为为:0.05mol?L-1?min-1;X转化的物质的量为1.0mol-0.7mol=0.3mol,转化率为0.3/1.0×100%=30%;根据图象中可知,平衡时,Y的浓度为0.9/2=4.5mol/L(3)反应前后气体物质的量不同,当压强不变时,气体的物质的量不变,达到化学平衡状态,A正确;气体的物质的量不变才能使X的体积分数不再发生变化,达到化学平衡状态,B正确;根据原子守恒定律,无论平衡与否,容器内气体原子总数都不会发生变化,C错误;相同时间内消耗2n mol的Z的同时消耗n mol的Y,该描述说明V(正)=V(逆),D正确;相同时间内消耗n mol的Y的同时消耗3n mol的X,该描述说明V(正)=V(正),E错误。下列叙述能说明该反应已达到化学平衡状态的是ABD。
考点:考查物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断等知识。
本题难度:一般
3、填空题 火力发电时排出的烟气中含有SO2,会造成一系列环境和生态问题。工业上利用的海水脱硫是一种有效的方法,工艺流程如图:
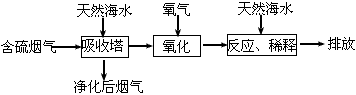
(1)天然海水呈碱性,请写出SO2与OH-反应的离子方程式:____。
(2)天然海水吸收含硫烟气后溶有H2SO3分子,用氧气将其氧化的化学方程式为:___。氧化后的“海水”需要引入大量天然海水与之混合后才排放的主要目的是____。
(3)为测定烟气中SO2的含量,将标准状况下500 mL的烟气通入20 mL 0.05 mol.L-1的高锰酸钾溶液,恰好使紫色刚好褪去:
①请配平方程式:___KMnO4+____SO2+____H2O==___MnSO4+____ K2SO4+___H2SO4
②所通烟气中SO2的体积百分含量为___。
(4)工业上常用可逆反应:2SO2+O2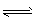 2SO3 △H<0制备硫酸,下列对该反应的说法不正确的是____。
2SO3 △H<0制备硫酸,下列对该反应的说法不正确的是____。
A.当单位时间内消耗2 mol SO2的同时生成2 mol SO3,说明此时该反应达到平衡状态
B.升高温度,可以增大正、逆反应速率,平衡向右移动
C.温度不变,增大压强时,平衡向右移动
D.工业上通常在该反应中使用催化剂来提高SO2的转化率
参考答案:(1) SO2+2OH-=SO32- +H2O (或SO2+OH-=HSO3-)
(2)2H2SO3+O2=2H2SO4?;中和、稀释氧化后海水中生成的酸(H+)
(3)①2KMnO4+5SO2+2H2O=2MnSO4+ K2SO4+2H2SO4? ;11. 2%
(4) ABD
本题解析:
本题难度:一般
4、选择题 汽车尾气净化中的一个反应:NO(g) + CO(g)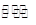 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
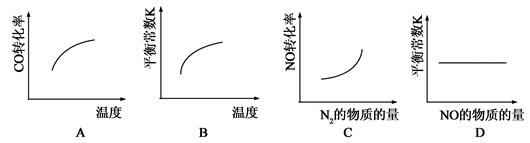
参考答案:D
本题解析: A、由于该反应是放热反应,温度升高,平衡向左移动,CO的转化率会降低,错误;B、温度升高,平衡向左移动,平衡常数K会减小,错误; C、增加N2的物质的量,恒容条件下提高了生成物N2浓度,平衡向左移动,NO的转化率会降低,错误;D、平衡常数K只与反应本身和温度有关与其他因素无关,正确。
考点: 影响化学平衡移动的因素与图像关系。
本题难度:一般
5、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。 (1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g) +2H2O(g) △H = -574 kJ/mol
CH4(g) +4NO(g) = 2N2(g) +CO2(g) +2H2O(g) △H = -1160 kJ/mol
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 _______________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) +6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
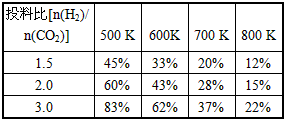
①若温度升高,则反应的平衡常数K将_________(填“增 大”“减小”或“不变”,下同);若温度不变,提高投料比[n(H2) /n(CO2)],则K将__________。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式__________________。
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12 L/min(标准状况),并以该电池作为电源电解2 mol/L CuSO4溶液500 mL,则通电30s后理论上在阴极可析出金属铜____g。
参考答案:(1)CH4(g) +2NO2(g) = N2(g) + CO2(g) + 2H2O(g) △H= -867 kJ/mol
(2)①减小;不变;②CH3OCH3- 12e- + 16OH- = 2CO32- + 11H2O;③9.6
本题解析:
本题难度:一般