微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?

?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为______mol?L-1?S-1.
(2)该反应的化学平衡常数表达式为K=______.
(3)下表是不同温度下测定得到的该反应的化学平衡常数.
据此可推测该反应(生成NO2)是______反应(选填“吸热”或“放热”).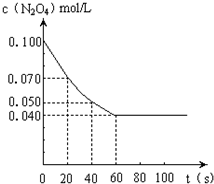
2、简答题 373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应:
PCl5?(g)

PCl3(g)+Cl2?(g).其中物质PCl3的物质的量变化如右图所示.
(1)前20s内PCl5(g)的平均反应速率为______
(2)373K时该反应的平衡常数的值为______
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率______(填“增大”或“减小”,下同).PCl5的平衡浓度______
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为______(填“放热反应”或“吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)______
a.升高温度?b.扩大容器的体积
c.加入合适的催化剂?d.再充入PCl3.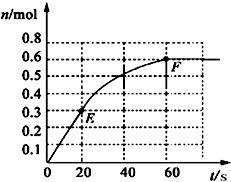
3、选择题 下列对化学反应限度的叙述中错误的是
[? ]
A.任何可逆反应在给定条件下都有一定的限度
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度与时间的长短无关
D.化学反应的限度不随外界条件的改变而改变
4、填空题 钨是属于有色金属,也是重要的战略金属,钨矿在古代被称为“重石”.1783年被西班牙人德普尔亚发现黑钨矿也从中提取出钨酸,同年,用碳还原三氧化钨第一次得到了钨粉,并命名该元素.钨是的用途十分广,涉及矿山、冶金、机械、建筑、交通、电子、化工、轻工、纺织、军工、航天、科技、各个工业领域.现在高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)
W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为______.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为______;随温度的升高,H2与水蒸气的体积比减小,则该反应正反应为______反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃
主要成份
WO3W2O5WO2W
|
第一阶段反应的化学方程式为______;580℃时,固体物质的主要成分为______;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为______
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2(g)WI4(g).下列说法正确的有______.
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
5、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)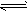 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:

回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________。
(2)该反应为_____________反应(填“吸热”“放热”)。