微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列过程不发生氧化还原反应的是
[? ]
A.Cl2溶于水
B.制漂白粉
C.实验室制CO2
D.实验室制Cl2
参考答案:C
本题解析:
试题分析:
选项A,Cl2溶于水,与水发生反应生成盐酸和次氯酸,氯元素的化合价变化,是氧化还原反应。
选项B,制漂白粉用Cl2与石灰乳反应,氯元素的化合价变化,是氧化还原反应。
选项C,实验室制CO2,用大理石与盐酸反应,反应前后元素化合价不变,非氧化还原反应。
选项D,实验室制Cl2,用MnO2与浓盐酸反应,Mn和Cl元素化合价变化,是氧化还原反应。
故选:C
本题难度:简单
2、选择题 下列反应中不属于氧化还原反应的是
A.NO+NO2+2NaOH==2NaNO3+H2O
B.NH3+HCl== NH4Cl
C.Br2+2KI==I2+2KBr
D.2H2O2==2H2O+O2↑
参考答案:B
本题解析:氧化还原反应的实质是原子获得(或偏向)电子的过程,表现为元素的化合价的升高(或降低)。标出各元素的化合价,可知A选项的N,C选项的Br和I,D选项的O的化合价反应前后发生变化,故只有B不属于氧化还原反应。
点评:氧化还原反应是高考的必考内容,考生应把握以下两点:一、判断一个反应是否属于氧化还原反应,以及氧化剂(产物)、还原剂(产物)分别是什么;二、利用得失电子配平所给化学反应,并能进行简单的有关于电子守恒的计算。
本题难度:简单
3、填空题 (8分)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,??是氧化剂;?是还原剂;?元素被氧化;?元素被还原;?是氧化产物;??是还原产物;1mol K2Cr2O7反应时转移电子为?mol.
参考答案:(最后一空2分,其余每空1分,共8分)
K2Cr2O7?HCl? Cl? Cr? Cl2?CrCl3?6mol
本题解析:根据方程式可知,铬元素的化合价从+6价降低到+3价,得到3个电子。氯元素的化合价从-1价升高到0价,失去1个电子。所以K2Cr2O7是氧化剂,HCl是还原剂。Cl元素被氧化,Cr被还原。氯气是氧化产物,CrCl3是还原产物。根据化合价的变化可知,1mol K2Cr2O7反应时转移电子为2mol。
点评:判断氧化还原反应是最关键的是准确判断出有关元素的化合价变化情况,然后根据相应的概念判断即可。而在氧化还原反应的计算中,电子得失守恒是经常用到的关系式。
本题难度:简单
4、选择题 根据以下事实得出的判断一定正确的是


A.HA的酸性比HB的强,则HA溶液 pH比HB溶液的小

B.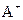 和
和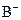 的电子层结构相同,则A原子的核电荷数比B原子的大
的电子层结构相同,则A原子的核电荷数比B原子的大

C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大

D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
参考答案:B
本题解析:A项中由于两种酸的浓度不知,无法比较pH大小,故错误。C项没有限定是饱和溶液,C项也错误。单质还原性强弱与失电子难易有关,与数目没有必然关系, 故D错误。
本题难度:一般
5、选择题 下列粒子氧化性最强的是(? )
A.H+
B.Fe2+
C.Cu2+
D.Ag+
参考答案:D
本题解析:依据金属活动性顺序的反方向,判断离子氧化性强弱应为:氧化性:K+<Ca2+<Na+<…H+<Cu2+<…Ag+。
本题难度:简单