微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 纳米技术制成的金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
离能(kJ·mol-1)
| I1
| I2
| I3
| I4
|
A
| 932
| 1 821
| 15 390
| 21 771
|
B
| 738
| 1 451
| 7 733
| 10 540
|
?
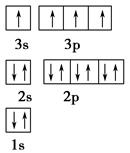
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。
(2)ACl2分子中A的杂化类型为________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确________,并阐述理由___________________。
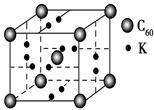
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。
参考答案:(1)能量最低原理 (2)sp杂化 (3)否 C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键
(4)4s1 3︰1 (5)N>C>Si 正四面体 30
本题解析:(1)E(3s)<E(3p),3s轨道排满才能排3p;(2)由表格电离能可推测出A是Be,B是Mg,BeCl2中心原子的价层电子对数为2,采取sp杂化;(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同;(4)K原子序数为19,价电子为4s1,从晶胞可看出C60的个数8×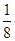 ?+1=2,K原子的个数12×
?+1=2,K原子的个数12×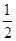 ?=6,K原子和C60分子的个数比为3︰1;(5)根据同周期、同主族元素原子的电负性递变规律可知:C、Si、N原子电负性由大到小的顺序是N>C>Si;NCl3中心原子价层电子对数为4,VSEPR模型为正四面体;Si的价电子数为4,每个硅原子只跟相邻的3个硅原子相连且最外层都满足8电子稳定结构,所以每个Si原子周围只有1个π键,且2个Si共用1个π键,所以一个Si60分子中π键的数目为(60×1)×
?=6,K原子和C60分子的个数比为3︰1;(5)根据同周期、同主族元素原子的电负性递变规律可知:C、Si、N原子电负性由大到小的顺序是N>C>Si;NCl3中心原子价层电子对数为4,VSEPR模型为正四面体;Si的价电子数为4,每个硅原子只跟相邻的3个硅原子相连且最外层都满足8电子稳定结构,所以每个Si原子周围只有1个π键,且2个Si共用1个π键,所以一个Si60分子中π键的数目为(60×1)×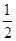 =30。
=30。
本题难度:困难
2、选择题 下列物质中,有共价键的单质是
[? ]
A.N2
B.CH4
C.NaCl
D.MgCl2
参考答案:A
本题解析:
本题难度:简单
3、选择题 短周期元素X、Y、Z,它们的原子最外层电子数依次为1、6、6,Z位于Y的上一周期,则X、Y、Z三种元素形成的某种化合物的化学式可能为( )
A.XY2Z3
B.X2YZ4
C.X3YZ4
D.X3YZ3
参考答案:短周期元素X、Y、Z,它们的原子最外层电子数依次为1、6、6,则X处于ⅠA族,Y、Z处于ⅥA,Z位于Y的上一周期,则Z为氧元素,Y为硫元素.X为+1价,Y、Z可以形成SO32-,SO42-.所以X、Y、Z三种元素形成的某种化合物的化学式可能为X2YZ3、X2YZ4.
故选B.
本题解析:
本题难度:一般
4、简答题 以下是元素周期表的一部分,回答下列有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
(11)
(12)
|
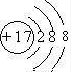
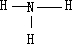
(1)写出⑥的元素符号:______,⑧的离子结构示意图______,②的单质的电子式______,①的氢化物结构式______.
(2)在这些元素中,最不活泼的元素是______(用元素符号作答).
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是______;(用化学式作答,下同)碱性最强的是______;呈两性的氢氧化物的是______.
(4)在这些元素中,原子半径最大的是______(用元素符号作答).
(5)这些元素中形成的碱性最强的碱与呈两性的氢氧化物恰好反应的离子方程式是______.
参考答案:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,(11)为Ca,(12)为Br,
(1)⑥为硅,元素符号为Si,Cl的质子数为17,容易得到1个电子变为离子,离子结构示意图为
,F2的电子式为
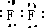
,氨气的结构式为
,
故答案为:Si;

;
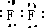
;

;
(2)上述元素中只有Ar原子的最外层电子数为8,性质不活泼,故答案为:Ar;
(3)上述元素中Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,
故答案为:HClO4;KOH;Al(OH)3;?
(4)电子层越多,半径越大,同一周期,从左到右半径在减小,则K的原子半径最大,故答案为:K;
(5)KOH为碱性最强的碱,Al(OH)3为两性氢氧化物,恰好反应的离子方程式为Al(OH)3+OH?-=AlO2?-+2H2O,故答案为:Al(OH)3+OH?-=AlO2?-+2H2O.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是?
A.构成单质分子的微粒一定含有共价键
B.熔融时能导电的化合物,一定是离子化合物
C.水加热至1000℃也不分解,是由于水分子间存在氢键
D.由H原子形成1molH-H键所要吸收的能量就等于H-H的键能
参考答案:B
本题解析:A、稀有气体的单质中不存在任何化学键,错误;B、共价化合物熔融时仍为分子或原子状态,不存在自由移动的离子,所以熔融时能导电的化合物,一定是离子化合物,正确;C、水难分解是因为水分子中的H-O键强度大,错误;D、成键时放出能量,断键时吸收能量,错误,答案选B。
本题难度:一般