微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某固体混合物可能由SiO2、Fe2O3、A12O3、Na2SO3、Na2CO3中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:
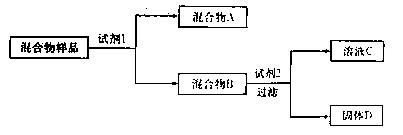
请回答下列问题:
(1)若试剂1是稀硫酸,试剂2是氢氧化钠溶液。在混合物样品中加以足量的稀硫酸后,固体全部溶解,得到混合气体A和澄清溶液B,在B中滴加过量氢氧化钠溶液时,先有沉淀生成,后沉淀部分溶解。则该混合物样品中一定不含的物质是?;固体D的化学式为?;检验混合物B中含有Fe3+所选用的试剂是?;证明混合气体A中含有CO2的实验方法是?。
(2)若试剂1是水,试剂2是氢氧化钠溶液(过量)。在混合物样品中加足量的水后过滤,混合物B是滤渣,试推断:固体D的化学式为?;检验溶液C中是否含有SiO32—的实验方法是?。
参考答案:1)SiO2(2分)? Fe(OH)3(2分)?硫氰化钾溶液(2分)?先将混合气体通过足量的高锰酸钾溶液洗气,除去SO2,再将剩余的气体通入澄清的石灰水中,若澄清的石灰水变浑浊,则可证明该混合气体中含有CO2(3分)
(2)Fe2O3 (2分)?取溶液C少许,逐滴滴入稀硫酸,有白色沉淀生成,继续滴加稀硫酸至过量,若白色沉淀不消失,则溶液C中含有SiO32-;若白色沉淀消失,则溶液C中不含SiO32-。(3分)
本题解析:略
本题难度:一般
2、填空题 常温下,A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,B、C、D都是含A元素的化合物,转化关系如图所示.
(1)分别写出A、B、C、D的化学式:
A______;B______.
C______;D______.
(2)写出B的电离方程式:______.
(3)写出下列反应的离子方程式
A→B______.
D→A______.
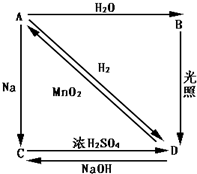
参考答案:A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,应为Cl2,和水反应生成B易分解,应为HClO,D为HCl,由转化关系可知C为NaCl,
(1)由以上分析可知A为Cl2,B为HClO,C为NaCl,D为HCl,故答案为:Cl2;HClO;NaCl;HCl;
(2)HClO为弱酸,部分电离,电离方程式为HClO?H++ClO-,故答案为:HClO?H++ClO-;
(3)氯气和水反应生成盐酸和次氯酸,反应的离子方程式为Cl2+H2O?H++Cl-+HClO,浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为
MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O,
故答案为:Cl2+H2O?H++Cl-+HClO;MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O.
本题解析:
本题难度:一般
3、填空题 (12分)某种常见的白色晶体A,与盐酸反应产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加氢氧化钡溶液微热,则析出白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1:1.根据以上事实,可以判断出A是?,B是?,C是?。
加热固体A生成水、B和D的化学方程式是_____________?,
A与盐酸反应的离子方程式___________________________________,
A与氢氧化钡溶液反应的离子方程式_______________________________________________。
参考答案:NH4HCO3? CO2? BaCO3? NH4HCO3 H2O + CO2↑ + NH3↑? HCO3- + H+ = CO2 +H2O?
H2O + CO2↑ + NH3↑? HCO3- + H+ = CO2 +H2O?
NH4+ + HCO3- + Ba2+ ?+ 2OH- = BaCO3↓+ NH3↑+ 2H2O
本题解析:略
本题难度:一般
4、简答题 已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-.如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题.电解质A的水溶液焰色反应呈浅紫色.
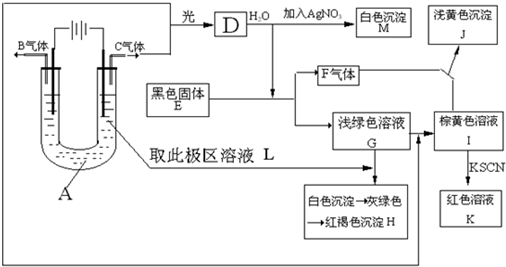
(1)写出A的化学式为______,E的名称为______.
(2)I与F作用的离子方程式是______
(3)G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:______
(4)用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+
①______,②______.
参考答案:电解质A的水溶液焰色反应呈浅紫色,由此可知电解质A含有钾元素;二价铁离子显浅绿色,所以G含二价铁离子,G和L反应生成H,根据实验现象知,H 是氢氧化铁,所以溶液L含氢氧根离子,即电解A后,电解液中含有氢氧根离子;C和G反应生成I,I和硫氰化钾反应生成红色溶液K,三价铁离子显黄色,所以I含三价铁离子,二价铁离子和C反应生成三价铁离子,所以C是氯气,I是氯化铁溶液,G是氯化亚铁溶液,所以A是氯化钾;电解氯化钾溶液时,生成物是氯气、氢气和氢氧化钾,所以B是氢气,L是氢氧化钾溶液;B和C光照生成D,氢气和氯气光照生成氯化氢,所以D是氯化氢;氯化氢溶于水得盐酸,盐酸和硝酸银反应生成白色沉淀氯化银,所以M是氯化银;黑色固体E和盐酸反应生成硫化亚铁和气体F,F和氯化铁反应生成淡黄色沉淀J,淡黄色固体有过氧化钠、硫、和溴化银;过氧化钠在溶液中不存在,所以不是过氧化钠,氯化铁和气体不能生成溴化银,所以淡黄色沉淀是硫,黑色固体是硫化亚铁,气体F是硫化氢气体.
(1)通过以上分析知,A为KCl;E是硫化亚铁.
故答案为:A:KCl?E:硫化亚铁.
(2)通过以上分析知,I是氯化铁溶液,F是硫化氢,氯化铁有氧化性,硫化氢有还原性,所以氯化铁和硫化氢能发生氧化还原反应生成氯化亚铁和硫单质、盐酸,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+.
故答案为:2Fe3++H2S=2Fe2++S↓+2H+.
(3)通过以上分析知,G是氯化亚铁溶液,L是氢氧化钾溶液,氯化亚铁和氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,能被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
(4)因为Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+,所以只要在同一反应方程式中Fe3+作氧化剂,
Cu2+作氧化产物即可证明三价铁离子的氧化性大于铜离子的氧化性,2Fe3++Cu=2Fe2++Cu2+;?在另一反应方程式中,铜离子作氧化剂,亚铁离子作氧化产物即可证明铜离子的氧化性大于亚铁离子的氧化性Fe+Cu2+=Fe2++Cu.
故答案为:2Fe3++Cu=2Fe2++Cu2+;Fe+Cu2+=Fe2++Cu.
本题解析:
本题难度:一般
5、填空题 (14分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
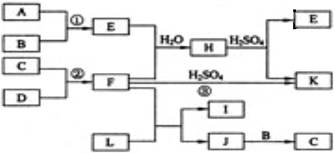
请按要求填空:
⑴反应③的化学方程式______________。
(2)写出制取化合物L的离子方程式______________。
(3)C的结构式______________;H的化学式______________。
(4)L的溶液与化合物E反应的离子方程式______________。
(5)化合物J的化学式______________,写出与化合物J等电子体的分子的分子式(2种)
______________
参考答案:略
本题解析:略
本题难度:简单