微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)处于相邻2个周期的主族元素A、B、C、D。它们原子半径依次减小。A离子和B离子的电子层相差2层,且能形成BA2型的离子化合物。C的离子带3个单位正电荷。D的气态氢化物通式为H2R,在其最高价氧化物中D质量分数为40%。D的原子序数大致等于其原子量数值的一半。试回答
①A是______ B是______ C是______ D是______(填元素符号)
②B、C、D单质的还原性从大到小的顺序是___________。
③向D的氢化物的水溶液中,滴入少量A单质的水溶液,写出反应方程式_____________________________________。
参考答案:略
本题解析:略
本题难度:一般
2、选择题 能实现下列物质间直接转化的元素是( )
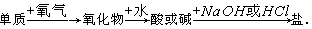
A.硅
B.硫
C.铜
D.铁
参考答案:B
本题解析:
本题难度:一般
3、填空题 已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
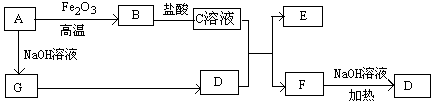
请回答下列问题:
(1)写出F的电子式:?
(2)①C溶液与D反应的离子方程式为?
②F溶液与NaOH溶液共热反应的化学方程式为?
(3)①请用离子方程式解释C溶液为何显酸性?
②F溶液中离子浓度由大到小的顺序为?
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是?(填代号)
A.HNO3溶液? B.H2SO4溶液? C.NaOH溶液? D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)=?mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度?(填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为?(用含a的代数式表示)
参考答案:(1)
(2)①Al3++ 3NH3·H2O=Al(OH)3↓+3NH4+ ?②NH4Cl+NaOH=NaCl+NH3↑+H2O
(3)①Al3++3H2O Al(OH)3+3H+?②c(Cl-) > c(NH4+) > c(H+)>c(OH-)
Al(OH)3+3H+?②c(Cl-) > c(NH4+) > c(H+)>c(OH-)
(4)D
(5)①0.8?②小于 ③
本题解析:根据题目给定的信息机相应的转化关系可知:A:Al;B:Al2O3;C:AlCl3;D:NH3;E:Al(OH)3;F:NH4Cl;G:H2.(1)氯化铵的电子式略。(2)①C溶液与D反应的离子方程式为:Al3++ 3NH3·H2O=Al(OH)3↓+3NH4+。②F溶液与NaOH溶液共热反应的化学方程式为NH4Cl+NaOH NaCl+NH3↑+H2O。(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O
NaCl+NH3↑+H2O。(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O Al(OH)3+3H+。②NH4Cl发生电离:NH4Cl=NH4++Cl-。由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+) > c(H+)>c(OH-)。(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。2Al+6H+=2Al3++3H2↑; 2Al+2H2O+2OH-=2AlO2-+ 3H2↑.溶液n(Al)=" 5.4g÷27g/mol=0.2mol." 由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3 n(Al)=3×0.2mol=0.6mol.n(酸)="0.2×2mol=0.4mol." n(H+)="a" n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属灰完全反应。不成立。所以选项为:D。(5)N2+3H2
Al(OH)3+3H+。②NH4Cl发生电离:NH4Cl=NH4++Cl-。由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+) > c(H+)>c(OH-)。(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。2Al+6H+=2Al3++3H2↑; 2Al+2H2O+2OH-=2AlO2-+ 3H2↑.溶液n(Al)=" 5.4g÷27g/mol=0.2mol." 由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3 n(Al)=3×0.2mol=0.6mol.n(酸)="0.2×2mol=0.4mol." n(H+)="a" n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属灰完全反应。不成立。所以选项为:D。(5)N2+3H2 2NH3。在反应方程式中V(H2):V(NH3)="3:2." V(H2)= 1.2mol/(L·min),则V(NH3)=2/3 V(H2)="2//3×1.2mol/(L·min)=0.8" mol/(L·min). ②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为a/2 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于a/2 mol/L。③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K=
2NH3。在反应方程式中V(H2):V(NH3)="3:2." V(H2)= 1.2mol/(L·min),则V(NH3)=2/3 V(H2)="2//3×1.2mol/(L·min)=0.8" mol/(L·min). ②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为a/2 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于a/2 mol/L。③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K= 。
。
本题难度:困难
4、推断题 A-G的转化关系如图所示(部分反应物、产物和反应条件未标出)

已知:
①A、B为中学化学常见的金属单质;C-G均为化合物,并且E和G均含有3种元素;
②C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应;
③F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀;
④E和G焰色反应均呈黄色。
根据以上信息回答下列问题:
(1)写出物质G的化学式:_____________。
(2)①-⑥反应中,不属于氧化还原反应的是______________ ;
(3)反应③的离子方程式为_____________ ;
(4)反应⑦对应的总化学方程式为 ________________;
(5)反应③中,若有31.2g C参加反应,转移电子的物质的量为______________ 。
参考答案:(1)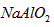
(2)⑥
(3)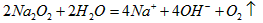
(4)
(5)0.4mol
本题解析:
本题难度:一般
5、填空题 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
?
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是?,②元素的氧化物的电子式是?,②与⑧形成的化合物中存在的化学键是?,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是?(用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是?(用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
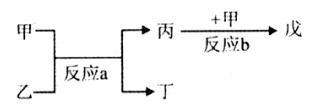
①写出反应a的化学方程式:?。
②写出戊与丁反应的化学方程式:??。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。
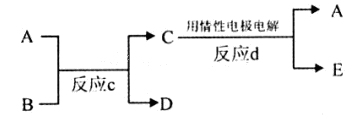
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为:?。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为?。
参考答案:(1)第三周期第ⅥA;(2分)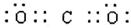 (1分)
(1分)
共价键(1分)H2CO3、H2SO4、HClO4;(1分)S2―>Cl―(1分)
(2)①4NH3+5O2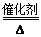 4NO+6H2O(2分)
4NO+6H2O(2分)
②3NO2+H2O=2HNO3+NO(2分)
(3)?①Cu2++2e―=Cu(2分)
②2Al+Fe2O3 2Fe+Al2O3(2分)
2Fe+Al2O3(2分)
本题解析:(1)②的原子序数不可能是1,由②在周期表中的位置可知,②处于第二周期,⑦⑧处于第三周期,②与⑦形成的液体化合物是常见的重要溶剂,该化合物为SC2或CCl4,由②⑦⑧的位置可知,②为碳,⑦为硫,⑧为氯,②与⑧形成的液体化合物为CCl4,S原子原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族;二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为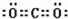 ;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
(2)戊为红棕色气体,则戊为NO2,反应b为NO+O2→NO2,由反应a可知,甲与乙反应生成丙,故甲为O2,故丙为NO,反应a为NH3+O2→NO+H2O,乙为NH3,丁为H2O,
①反应a的化学方程式为:4NH3+5O2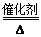 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2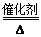 4NO+6H2O;
4NO+6H2O;
②NO2与H2O反应生成HNO3、NO,反应方程式为:3NO2+H2O=2HNO3+NO↑,故答案为:3NO2+H2O=2HNO3+NO↑;
(3)①A是红色金属单质,A为Cu,E是具有黄绿色的气体,则E为Cl2,反应d中阴极发生还原反应,是铜离子放电生成Cu,反应d中阴极电极反应式为:Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②若反应c是在高温下进行的,物质C是一种两性化合物,为Al2O3,其中B是暗红色固体,为Fe2O3,反应c为铝热反应,A为Al、D为Fe、E为O2,反应c的方程式为:Fe2O3+2Al 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3.
2Fe+Al2O3.
本题难度:一般