微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 过氧化尿素[CO(NH2)2·H2O2 ]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
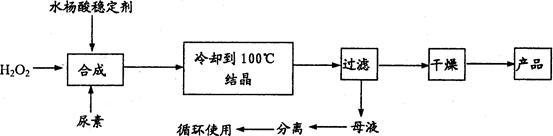
试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25—30℃,其主要原因是___________________________________。
(2)从母液中分离出H2O2和尿素,采用的操作是___________。
(a)盐析?过滤?(b)分液?过滤?(c)减压蒸馏?结晶?(d)常压蒸馏?萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在________式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:__MnO4-+ ___H2O2+___H+=___Mn2++ ____H2O+___?_____
③根据滴定结果,可确定产品中活性氧的质量分数为:___________。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量______(选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为_________。
参考答案:(1)H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化 尿素的纯度(2分).
尿素的纯度(2分).
(2)c(2分)
(3)①酸(2分);②2,5,6=2,8, 5O2;(2分)③13.3%(2分);
④偏高(2分)?⑤尿素(写水杨酸稳定剂也得分)(2分)
本题解析:略
本题难度:简单
2、推断题 A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,A为黄绿色,E为金属。其中D 能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如图所示(反应条件均已略去)。回答下列问题
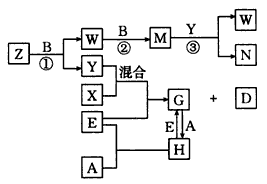
(1)A的化学式为_________。
(2)写出反应③的化学方程式_________________。
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为______________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3. 01×1023,则参加反应的E的质量为____________g。
参考答案:(1)Cl2
(2)3NO2+H2O=2HNO3+NO
(3)4NH3+6NO 5N2+6H2O
5N2+6H2O
(4)14
本题解析:
本题难度:一般
3、推断题 常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下图所示。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198g·mol-1,且其中各元素的质量比为钾:金属B:氧=39:28:32。
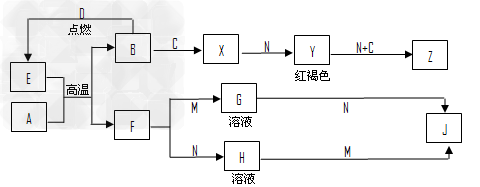
请回答以下问题:
(1)Z的化学式为______________。
(2)写出检验X中阳离子的方法:________________。
(3)写出E和A在高温下反应的化学方程式:______________。
(4)写出A和N反应的离子方程式:_______________。
参考答案:(1)K2FeO4?
(2)取试样少许,滴加3-4滴KSCN溶液,呈血红色
(3)8Al+3Fe3O4 4Al2O3+9Fe
4Al2O3+9Fe
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:
本题难度:一般
4、推断题 相对分子质量为248的A·5H2O是无色透明晶体,无臭,味咸,在纺织工业中用于棉织品漂白后的脱氯剂等用途。甲是淡黄色固体、不溶于水,易溶于二硫化碳;乙、丙是气体,反应①可以制取三种重要的化工原料,乙可与E反应;D ?是形成酸雨的污染物,F是过量的E与D反应后的物质。如图是关于A及相关物质性质与制备A的相互转化关系。?
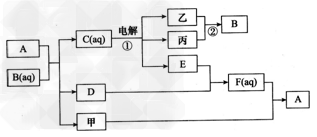
(1)写出E的电子式:________,组成乙的元素原子结构示意图是________,反应②的条件是___________。 ?
(2)写出反应①电解的阴极电极反应式:_____________ 。?
(3)写出A与B溶液反应的离子方程式:_______________。 ?
(4)写出甲与F溶液反应制备A的化学方程式:_______________。
参考答案:(1)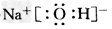 ?;
?;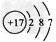 ;? 点燃
;? 点燃
(2)2H2O+2e-=H2↑+2OH-?
(3)S2O32-+2H+=S↓+SO2↑+H2O
(4)Na2SO3+S=Na2S2O3
本题解析:
本题难度:一般
5、简答题 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.
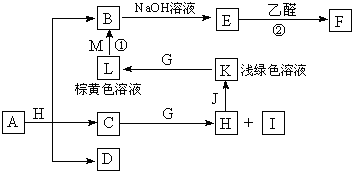
据此回答下列各题:
(1)写出纯净物A的化学式______,C的电子式______,用来检验L中阳离子的试剂是______(该试剂焰色为紫色).
(2)沉淀E可溶于过量______(填试剂名称)得到深蓝色的透明溶液,呈现该颜色是因为溶液中存在配离子______(填化学式).
(3)写出反应①的离子方程式______,写出反应②的化学方程式(有机物用结构简式表示)______.
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体,请写出该反应的化学方程式______.
参考答案:X在周期表中的原子半径最小,为H元素,Y、Z原子最外层电子数之和为10,“X、Y、Z的原子序数依次增大”,进而推出D(由H、C、O中的两种元素组成;无色非可燃性气体)为CO2,可以知道X、Y、Z是H、C、O,则C为H2O,H为HCl,I有漂白作用,应为HClO,浅绿色、棕黄色溶液为Fe2+和Fe3+,可知J为Fe,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,E能与乙醛反应,应为Cu(OH)2,F为Cu2O,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,
(1)由以上分析可知A是CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,C为H2O,电子式为
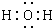
,L为FeCl3,用来检验L中阳离子的试剂是硫氰化钾,
故答案为:CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3;
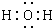
;硫氰化钾;
(2)E为Cu(OH)2,可与氨水发生络合反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,
故答案为:氨水;[Cu(NH3)4]2+;
(3)反应①为氯化铁和铜的反应,反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,乙醛和氢氧化铜浊液在加热的条件下反应的方程式为CH3CHO+2Cu(OH)2+NaOH△
本题解析:
本题难度:一般