微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A.醋酸的电离平衡常数:B点>A点
B.由水电离出的c(OH-):B点>C点
C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:D
本题解析:中和反应是放热反应,在B点时恰好完全反应,B点为CH3COONa溶液,溶液显碱性,水的电离程度最大,溶液温度最高时醋酸的电离平衡常数最大,A、B选项正确;从A点到B点混合溶液可能显中性,依据电荷守恒可知C选项正确;在C点时为等浓度的CH3COONa、NaOH混合溶液,c(OH-)>c(CH3COO-),D选项错误。
本题难度:一般
2、填空题 某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为?。.
参考答案:4.7
本题解析:根据电荷守恒可知,氢离子浓度是4.5×10-5 mol/L+2.5×10-6 mol/L×2-7.0×10-6mol/L-2.3×10-5 mol/L=2.4×10-5 mol/L,所以pH=4.7。
本题难度:一般
3、填空题 按要求回答下列问题
(1)某温度下,纯水中c (H+)=2.0×10-7 mol·L-1,则此时c (OH-) =?mol·L-1
0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_____。
(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因是?;已 知该混合溶液中c (Na+) > c (CN-),则c (HCN)?c (CN-)(用“>”、“<”、“=”符号填空)。
(3)向1L 0.10 mol·L-1的HCN溶液中加入0.08molNaOH固体,得到混合溶液,则_________和__________两种粒子的物质的量之和等于0.1mol;写出该混合溶液中存在的所有平衡的表达式?。
参考答案:(1)2.0×10-7 (2分) ;13 (2分)
(2)CN-浓度增大,抑制了HCN的电离,使C(H+)降低,pH值增大,>(2分)
(3)HCN、 CN-(2分,少答一个不得分);
HCN  ?H++ CN-(1分);H2O
?H++ CN-(1分);H2O  ?H+ + OH-(1分);CN-+ H2O
?H+ + OH-(1分);CN-+ H2O HCN+ OH- (1分);
HCN+ OH- (1分);
本题解析:(1)纯水呈中性,即c (H+)="c" (OH-) =2.0×10-7 mol·L-1,Kw=4.0×10-14,0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合,
c (OH-) =(0.9-0.1)/2=0.4mol/L,故c (H+)="Kw/c" (OH-)=4.0×10-14/0.4mol/L=10-13mol/L,所以pH="-lgc" (H+)=13;(2)向0.020 mol·L-1的HCN溶液中加入0.020 mol NaCN固体,溶液pH增大,主要原因为CN-浓度增大,抑制了HCN的电离,使C(H+)降低,pH值增大,因为c (Na+) > c (CN-),根据电荷守恒c (H+)+c (Na+)="c" (CN-)+c (OH-),,即该溶液层碱性,所以HCN的电离小于水解,即c (HCN)>c (CN-);(3)根据物料守恒,可以知道)HCN、 CN两种粒子的物质的量之和等于0.1mol;该溶液为NaCN和HCN的混合溶液,所以混合溶液中存在的所有平衡的表达式为CN  ?H++ CN-;H2O
?H++ CN-;H2O  ?H+ + OH-;CN-+ H2O
?H+ + OH-;CN-+ H2O HCN+ OH- 。
HCN+ OH- 。
点评:本题综合考查了水的离子积、盐类水解、电荷守恒、质子守恒、pH的计算,有一定的综合性,该题有一定的难度。
本题难度:一般
4、选择题 用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是(? )
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
参考答案:A、D
本题解析:试题分析:
本题难度:一般
5、选择题 下列物质溶解于水中,能促进水的电离的是(? )
A.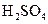
B.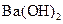
C.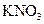
D.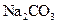
参考答案:
D
本题解析:
水的电离平衡是化学平衡的一种,影响 移动的因素,主要取决于温度和C(H+)、C(OH-)的大小。A项,C(H+)增大,平衡右移,抑制水的电离。B项 C(OH-)增大,平衡右移,抑制水的电离。C项,不影响水的电离,平衡不移动。D项,CO32—水解消耗水电离的H+,平衡左移,促进水的电离,D正确。
移动的因素,主要取决于温度和C(H+)、C(OH-)的大小。A项,C(H+)增大,平衡右移,抑制水的电离。B项 C(OH-)增大,平衡右移,抑制水的电离。C项,不影响水的电离,平衡不移动。D项,CO32—水解消耗水电离的H+,平衡左移,促进水的电离,D正确。
本题难度:简单