微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8 000 mg/L~10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液还具有的化学性质是_____性和_____性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是_____。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)设计方案,实施探究
用烧杯取少量样品,将一根光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是__________。
(5)基于假设②,结论是______________________。
参考答案:(1)碱性? ClO-+H2O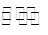 HClO+OH-
HClO+OH-
(2)氧化 漂白 不稳定(任写两个即可)
(3)CO2等酸性气体、光和热等
(4)铁钉表面出现铁锈(或红褐色固体)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象
本题解析:NaClO溶液显碱性,因HClO是弱酸,ClO-可以水解。又因HClO有强氧化性,可用于漂白,但HClO不稳定,空气中的CO2等酸性气体、光、热等会使其失效。若有明显现象,铁钉表面出现铁锈,则可说明该消毒液对铁钉有腐蚀作用。若无明显现象,则不能确定该消毒液对铁钉是否有腐蚀作用
本题难度:一般
2、选择题 有四种无色溶液,它们分别是(NH4)2SO4、NH4Cl、Na2CO3、NaNO3,下列试剂中可以用来鉴别它们的是( )
A.BaCl2溶液
B.NaOH溶液
C.Ba(OH)2溶液
D.AgNO3溶液
参考答案:A.加入BaCl2溶液不能鉴别(NH4)2SO4和Na2CO3,故A错误;
B.加入NaOH溶液不能鉴别(NH4)2SO4、NH4Cl,故B错误;
C.加入Ba(OH)2溶液,(NH4)2SO4生成刺激性气体和白色沉淀,NH4Cl只生成刺激性气体,Na2CO3只生成白色沉淀,NaNO3无现象,可鉴别,故C正确;
D.加入AgNO3溶液,(NH4)2SO4、NH4Cl、Na2CO3都生成白色沉淀,不能鉴别,故D错误.
故选C.
本题解析:
本题难度:一般
3、实验题 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
工业ZnO 浸出液
浸出液
 滤液
滤液
 滤液
滤液
 滤饼
滤饼 ZnO
ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是?,发生反应的离子方程式为 ?。
加高锰酸钾溶液前,若pH较低,对除杂的影响是?。
(2)反应③的反应类型为?,过滤得到的滤渣中,除了过量的锌外还有?。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是?。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于?。?
参考答案:
(1)Fe2+和Mn2+?铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应?镍?
(3)取少量水洗液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净
(4)1
本题解析:
(1)根据题意,Ni(Ⅱ)不能被氧化,反应②中除掉的杂质离子是Fe2+和Mn2+,发生的离子方程式为MnO4-+3 Fe2++7H2O="3" Fe(OH)3↓+ MnO2+5H+;2MnO4-+3Mn2++2H2O=5MnO2↓+4H+。加高锰酸钾溶液前,若pH较低,铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质。
(2)反应③为锌与镍离子的反应,反应类型为置换反应,得到的滤渣中,除了过量的锌外还有金属镍。
(3)检验沉淀是否洗涤干净的方法是取少量水洗液于试管中,滴入1-2滴稀硝酸酸化,再滴入硝酸钡溶液,若无白色沉淀生成,说明没有硫酸根离子,则说明沉淀已经洗涤干净
(4)根据关系式ZnCO3·xZn(OH)2? --------------?(x+1)ZnO
125+99x? 81(x+1)
11.2g? 8.1g
解得:x=1?
【考点定位】工艺流程、化学实验、化学计算
本题难度:一般
4、实验题 在一个小烧杯里,加入?20?g?Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入10g?NH4Cl晶体,并用玻璃棒迅速搅拌.如下图所示.?
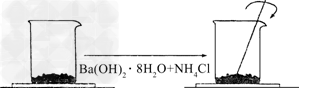
?回答下列问题:
(1)实验中玻璃棒的作用是______________________________;
(2)反应方程式是____________________,该反应属于________(填反应类型);
(3)实验中观察到现象有____________________;反应混合物呈糊状的原因是________________________;
(4)通过________现象,说明该反应为________热反应,这是由于反应物的总能量________生成物的总能量.
参考答案:(1)搅拌使混合物充分接触并起反应
(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O ;复分解反应
(3)玻璃片上结冰而与小烧杯粘结在一起 ;反应发生时有水生成
(4)结冰 ;吸 ;小于
本题解析:
本题难度:一般
5、实验题 (16分)汽车安全气囊是汽车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成淡黄色化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:?
(1)甲的化学式为?,丙的电子式为?。
(2)单质乙与红棕色粉末发生反应的化学方程式为?。
(3)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为?。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是?。
A. KCl? B. KNO3? C. Na2S? D. CuO
(5)某同学提出,丙在空气中也可能转化为另一种盐。将丙在空气中放置一段时间后,为探究其转化产物的成分,他提出如下方案:
A.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物充分加热,得b克固体
D.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
其中方案C首先得到老师肯定,据该方案实验后,若b与a满足?关系,则证明固体是两种盐的混合物。你认为,除方案C外,合理的方案还有?。
参考答案:(1)Na3N,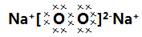
(2) 6Na+2Fe2O3=3Na2O2+4Fe
(3) 2N2O2+4CO2+2H2O=4NaHCO3+O2
(4)D?
(5)53/84a< b < a? B D
本题解析:(1)根据题意知,Na、Fe、N、O四种元素组成的化合物中不溶于水、可溶于盐酸的红棕色固体只有Fe2O3;在四种元素组成的单质中,在高温隔绝空气的条件下与Fe2O3反应的只有金属钠,单质乙是钠,淡黄色化合物丙为过氧化钠;化合物甲是由Na和N元素组成,13.0g化合物甲,加热使其完全分解,生成氮气和金属钠,生成的氮气折合成标准状况下的体积为6.72L,即0.3mol,经计算知Na和N的原子个数比是1:3,化合物甲的化学式为NaN3,过氧化钠的电子式为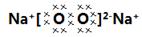 ;(2)金属钠与红棕色粉末氧化铁发生反应的化学方程式为6Na+2Fe2O3=3Na2O2+4Fe;(3)过氧化钠在空气中转化为碳酸氢钠和氧气,则反应的化学方程式为2N2O2+4CO2+2H2O=4NaHCO3+O2;(4)安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,选项中能和钠反应的是氧化铜,选D;(5)过氧化钠跟空气接触所得的可溶性的盐成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物,碳酸氢钠受热容易分解,碳酸钠受热难分解,可以用加热的办法来确定成分,C方案:取a克混合物充分加热,得b克固体,当固体为碳酸钠时,加热,固体不分解,反应前后固体质量不变,a=b;当固体为碳酸氢钠时,根据2NaHCO3
;(2)金属钠与红棕色粉末氧化铁发生反应的化学方程式为6Na+2Fe2O3=3Na2O2+4Fe;(3)过氧化钠在空气中转化为碳酸氢钠和氧气,则反应的化学方程式为2N2O2+4CO2+2H2O=4NaHCO3+O2;(4)安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,选项中能和钠反应的是氧化铜,选D;(5)过氧化钠跟空气接触所得的可溶性的盐成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物,碳酸氢钠受热容易分解,碳酸钠受热难分解,可以用加热的办法来确定成分,C方案:取a克混合物充分加热,得b克固体,当固体为碳酸钠时,加热,固体不分解,反应前后固体质量不变,a=b;当固体为碳酸氢钠时,根据2NaHCO3 Na2CO3 + CO2↑+ H2O知,固体质量减少,b=53/84a;当固体为二者的混合物时,53/84a< b < a;A、取a克混合物与足量稀硫酸充分反应,逸出气体二氧化碳和水蒸气均能被碱石灰吸收,无法确定混合物的组成;B、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克氯化钠固体,列方程组计算,可确定混合物组成;D、取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克碳酸钙固体列方程组计算,可确定混合物组成,选BD。
Na2CO3 + CO2↑+ H2O知,固体质量减少,b=53/84a;当固体为二者的混合物时,53/84a< b < a;A、取a克混合物与足量稀硫酸充分反应,逸出气体二氧化碳和水蒸气均能被碱石灰吸收,无法确定混合物的组成;B、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克氯化钠固体,列方程组计算,可确定混合物组成;D、取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克碳酸钙固体列方程组计算,可确定混合物组成,选BD。
本题难度:一般