微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—)
C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S)
参考答案:D
本题解析:A项,考查物料守恒,CH3COOH部分电离产生CH3COO-和H+,醋酸根原子团守恒,得c(CH3COO-)+ c(CH3COOH)=0.1mol/L。B项,根据电荷守恒关系式C(Na+)+ c(H+)= 2 c(CO32—)+ c(HCO3—)+ c(OH-)和物料守恒关系式c(Na+)= c(CO32—)+ c(HCO3—)+ c(H2CO3),可计算得到c(OH-) = c(H+) + c(H2CO3)-c(CO32—)。C项,CH3COO-水解显碱性,所以c(Na+)> c(CH3COO-),c(OH-)> c(H+)。因为OH-是水解产生的,量很小,所以c(OH-)> c(H+)排在后边。D项,考查的物料守恒,c(Na+)="2" c(S)=2【c(S2—) + c(HS—)+ c(H2S)】
本题难度:一般
2、选择题 把三氯化铁溶液蒸干灼烧,最后得到的固体产物是
[? ]
A.无水三氯化铁
B.氢氧化铁
C.氧化亚铁
D.三氧化二铁
参考答案:D
本题解析:
本题难度:简单
3、选择题 25℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得
c(Na+)>c(A-),则下列描述中,不正确的是(?)
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mo1+n(H+)
参考答案:A
本题解析:由c(Na+)>c(A-)得:在等浓度一元酸HA与其钠盐组成的混合溶液中,酸根离子水解程度大于酸的电离程度,所以溶液显碱性。A、该溶液的pH>7,错误;B、由以上分析知,正确;C、根据物料守恒,得c(A-)+c(HA)=0.02 mol·L-1,正确;D、根据电荷守恒,所以n(A-)+n(OH-)=n(Na+)+n(H+),其中n(Na+)=0.01mol,n(A-)+n(OH-)=0.01 mo1+n(H+),正确,答案选A。
本题难度:一般
4、填空题 (10分)室温下取0.2 mol·L-1HA溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)①混合溶液中水电离出的c(OH-)?0.1mol·L-1NaOH溶液中水电离出的c(OH-);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+) -c(A-)=??mol·L-1?
c(OH-)-c(HA) =??mol·L-1
(2)室温下如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH>7,则说明HA的电离程度?NaA的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为?。
参考答案:(1) ①>(2分)?②9.9×10-7(2分) 1.0×10-8(2分)
(2)<(2分)? c(Na+)>c(A-)>c(OH-)>c(H+)(2分)
本题解析:(1)①HA和氢氧化钠恰好反应,但溶液的pH=8,说明生成物水解显碱性,因此HA是弱酸。水解促进水的电离,区域内抑制水的电离,所以混合溶液中水电离出的c(OH-)>0.1mol·L-1NaOH溶液中水电离出的c(OH-)。
②根据电荷守恒定律可知c(Na+) +c(H+)=c(A-)+c(OH-),则c(Na+) -c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L。根据质子守恒可知c(OH-)=c(H+)+c(HA) ,所以c(OH-)-c(HA)=c(H+)=1.0×10-8mol/L。
(2)根据酸和碱的量可知,HA是过量的,即反应后溶液中是HA和NaA的混合液,且浓度相等。测得混合溶液的pH>7,这说明HA的电离程度小于NaA的水解程度,所以溶液显碱性。因此溶液中各离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+)。
本题难度:一般
5、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是
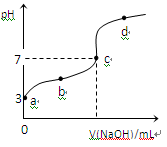
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液c(CH3COO-) > c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中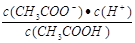 相等
相等
参考答案:C
本题解析:
答案C
恰好完全反应时,产物为CH3COONa,是强碱弱酸盐,水解后溶液呈碱性,pH>7
本题难度:一般