微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 回答下列问题:
Ⅰ、有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2 ⑤MgCl2 ⑥NH4Cl ⑦H2SO4
⑧C2H5OH(酒精)(用序号作答).
上述十种物质中,其中属于电解质的有______,属于非电解质的有______.
Ⅱ、今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol?L-1,SO42-的浓度是0.7mol?L-1.
(1)写出Al2(SO4)3电离的电离方程式:______.
(2)Al3+浓度应等于______mol/L
Ⅲ、根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是______,被氧化的是______元素.
(2)该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为______.
(3)用双线桥法标出电子转移的方向与数目______.
参考答案:I.①Fe是单质,既不是电解质也不是非电解质;②CO2 本身不能电离,属于非电解质;③Na2O是化合物且熔融状态下导电,属于电解质;④Cu(OH)2是化合物且熔融状态下导电,属于电解质;⑤MgCl2是化合物,在水溶液或者熔融状态都导电,属于电解质;⑥NH4Cl是化合物溶液中导电,属于电解质; ⑦H2SO4 是化合物溶液中导电,属于电解质;⑧C2H5OH(酒精)是化合物,在水溶液和融化状态下都不导电,是非电解质,故答案为:③④⑤⑥⑦;②⑧;
II.(1)硫酸铝是强电解质完全电离,电离方程式:Al2(SO4)3=2Al3++3SO42-;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(2)溶液呈中性,根据电荷守恒列关系式:C(Al3+)×3+C(K+)=2×C(SO42-),将各种离子浓度带入得:C(Al3+)×3+0.2mol?L-1=2×0.7mol?L-1.
C(Al3+)=0.4mol/L;
故答案为:0.4mol/L;
III (1)该反应氨气中的氯气中的氯元素化合价降低,所以氯气是氧化剂;氮元素化合价升高,被氧化;
故答案为:Cl2或氯气;N或氮;
(2)在反应8NH3+3Cl2=6NH4Cl+N2,3mol氯气中的氯元素化合价都降低,所以3mol氯气都做氧化剂;8mol氨气中只有2mol氨气中的氮元素化合价升高,所以做还原剂的氨气只有2mol,所以氧化剂和还原剂物质的量之比是3:2;
故答案为:3:2;
(3)根据得失电子守恒的原理用双线桥法标出电子转移的方向与数目.
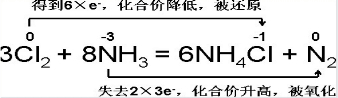 ;
;
故答案为: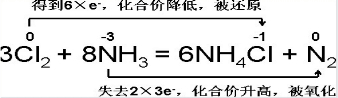 .
.
本题解析:
本题难度:一般
2、选择题 某盐的溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl-为0.4mol,则SO42-物质的量为( )
A.0.1mol
B.0.3mol
C.0.5mol
D.0.15mol
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列物质中属于电解质的是( )
A.CO2
B.BaSO4
C.Zn
D.食盐水
参考答案:A.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故A错误;
B.BaSO4在熔融状态下能导电,是电解质,故B正确;
C.金属Zn是单质,既不是电解质也不是非电解质,故C错误;
D.食盐水是混合物,不属于化合物,不属于电解质,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 常温下,有关醋酸溶液的叙述中错误的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)B.将pH=3的醋酸稀释为pH=4的过程中,c(CH3COOH)/ c(H+)比值不变
C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后:c(CH3COOˉ)+ c(CH3COOH)="2" c(Na+)
D.amLpH=3的醋酸溶液与bmLpH=11的NaOH溶液恰好完全中和时,a=b
参考答案:BD
本题解析:试题分析:由pH=5.6可知,混合溶液显酸性,其中c(H+)> c(OHˉ),根据电荷守恒原理可知,混合溶液中c(H+)+c(Na+)=c(CH3COOˉ)+c(OHˉ),因此c(Na+)<c(CH3COOˉ),故A正确;CH3COOH CH3COOˉ+ H+,则Ka(CH3COOH)= c(CH3COOˉ)? c(H+)/ c(CH3COOH),则稀释过程中电离常数保持不变,且1/ Ka(CH3COOH)=c(CH3COOH)/c(CH3COOˉ)? c(H+)也不变,但是稀释后c(CH3COOˉ)减小,则c(CH3COOH)/c(H+)增大,故B错误;CH3COOH
CH3COOˉ+ H+,则Ka(CH3COOH)= c(CH3COOˉ)? c(H+)/ c(CH3COOH),则稀释过程中电离常数保持不变,且1/ Ka(CH3COOH)=c(CH3COOH)/c(CH3COOˉ)? c(H+)也不变,但是稀释后c(CH3COOˉ)减小,则c(CH3COOH)/c(H+)增大,故B错误;CH3COOH CH3COOˉ+H+,CH3COONa==CH3COOˉ+Na+,CH3COOˉ+H2O
CH3COOˉ+H+,CH3COONa==CH3COOˉ+Na+,CH3COOˉ+H2O CH3COOH+OHˉ,则混合溶液中n(CH3COOˉ)+n(CH3COOH)=2n(Na+),根据物料守恒原理可知,c(CH3COOˉ)+c(CH3COOH)=2c(Na+),故C正确;若a=b,则混合前醋酸溶液的c(H+)=NaOH溶液的c(OHˉ),但是电离程度:CH3COOH <NaOH,则混合前n(CH3COOH)>n(NaOH),因此醋酸一定过量,而不是恰好完全中和,故D错误。
CH3COOH+OHˉ,则混合溶液中n(CH3COOˉ)+n(CH3COOH)=2n(Na+),根据物料守恒原理可知,c(CH3COOˉ)+c(CH3COOH)=2c(Na+),故C正确;若a=b,则混合前醋酸溶液的c(H+)=NaOH溶液的c(OHˉ),但是电离程度:CH3COOH <NaOH,则混合前n(CH3COOH)>n(NaOH),因此醋酸一定过量,而不是恰好完全中和,故D错误。
考点:考查溶液中粒子浓度大小关系,涉及溶液的酸碱性、电荷守恒关系式、弱酸的稀释、物料守恒关系式、弱酸与强碱的混合等知识。
本题难度:一般
5、填空题 在下列物质: A.烧碱 B.硫酸 C.干冰 D.铁片 E.纯碱
(1)属于电解质的有____________,
(2)在水中所电离出自由移动阴离子只有OH-的是_____________,
(3)纯碱的电离方程式是_________ 。
参考答案:(1)A.烧碱、B.硫酸、E.纯碱
(2)A.烧碱
(3)Na2CO3=2Na++CO32-
本题解析:
本题难度:一般