微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知33As、35Br位于同一周期,下列关系正确的是 (? )
A.原子半径:As>C1>P
B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1-
D.酸性:H3AsO4>H2SO4>H3PO4
参考答案:C
本题解析:同一周期元素自左到右原子半径变小故A中C1>P错;同一周期元素自左到右非金属性增强,氢化物的稳定性增强故B中 AsH3>HBr错;非金属性越强最高价氧化物的水化物的酸性也越强,非金属性S>P>As,故D错
本题难度:一般
2、选择题 下列说法正确的是(?)
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
参考答案:C
本题解析:A项:C的非金属性比Si强,即CH4比SiH4稳定,故错;B项:具有相同核外电子排布的离子,核电核数越大离子半径越小,即O2-半径比F-的大,故错;D项:P的非金属性比As强,即H3PO4酸性比H3AsO4的强,故错。故选C。
点评:本题考查的是元素周期律的应用,题目难度不大,注意对基础知识的学习、掌握及其应用。
本题难度:简单
3、选择题 下列叙述中错误的是?
A.还原性:Na>Mg>Al
B.原子半径:Cl>Si>O
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H2CO3
参考答案:B
本题解析:A 正确,金属性越强,还原性越强
B 错误,原子半径: Si >Cl>O
C 正确,半径越小越稳定
D 正确,非金属性越强,最高价含氧酸的酸性越强
本题难度:简单
4、选择题 前三周期元素中,基态原子中未成对电子与其所在周期数相同的元素有几种(?)
A.3种
B.4种
C.5种
D.6种
参考答案:B
本题解析:根据构造原理可知,第一周期是H,第二周期中有C、O。第三周期有P,所以共有4种元素。答案选B。
本题难度:一般
5、填空题 (8分)【化学-物质结构与性质】
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。

(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为?,B原子的杂化类型为?。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为?,微粒间存在的作用力为?。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。

①硼酸分子中B最外层有?个电子,1 mol H3BO3的晶体中有??mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2OB(OH)3,它电离生成少量[B(OH)4]-和的H+离子。则硼酸为?元酸, [B(OH)4]-含有的化学键类型为?。
参考答案:⑴平面三角形(1分)? sp2(1分)?⑵⑵Bp(1分)?共价键(1分)
⑶①6(1分)? 3(1分)?②一(1分)?共价键、配位键(1分)
本题解析:⑴BF3中B原子没有孤对电子,所以为平面三角形结构,因此B为sp2杂化。
⑵根据晶胞结构图,该晶胞中含有4个P,B原子的个数为8×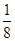 +6×
+6×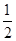 =4,因此化学式为BP。根据BP的性质及用途:耐磨涂料,可用作金属的表面保护层等可判断BP为原子晶体,微粒间作用力为共价键。
=4,因此化学式为BP。根据BP的性质及用途:耐磨涂料,可用作金属的表面保护层等可判断BP为原子晶体,微粒间作用力为共价键。
⑶①硼酸分子中B与三个原子形成单键,最外层有6个电子,根据图示,1个H3BO3分子与其他3个分子能形成6个氢键,因此1 mol H3BO3的晶体中氢键为6 mol×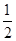 =3 mol。
=3 mol。
②硼酸溶于水,B原子与水电离出的OH-结合,产生H+,为一元酸,OH-中的O原子提供孤对电子,和B原子形成配位键。
本题难度:一般