| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《弱电解质电离平衡》试题巩固(2017年最新版)(十)
参考答案:C 本题解析:A、若为强酸,则应加水到体积是原来的10倍,若为弱酸,由于有电离平衡的移动,所以加水的体积要多,稀释的倍数大于10倍,所以A正确,不选;B、在甲溶液中水电离的氢氧根离子浓度为10-11mol/L,乙溶液中水电离的氢氧根离子浓度为10-10mol/L,所以B正确,不选;C、由于甲和乙中含有的一元酸的物质的量相等,所以用氢氧化钠中和后得到的盐的物质的量也相等,若为强酸,则溶液为中性,若为弱酸,溶液显碱性,而且浓度越小,其pH值越小,所以C错误,选C;D、根据酸碱混合时的规律,当pH加和等于14的酸碱等体积混合,谁弱显谁性。若酸为强酸,则反应后溶液为中性,认为甲反应后再加水稀释得到乙反应后的溶液,则溶液也为中性;若酸为弱酸,则反应后溶液显酸性,浓度越小,其pH越大,所以D正确,不选、 本题难度:一般 2、选择题 已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是
A.25℃,等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3 B.少量的SO2通入NaClO溶液中反应的离子方程式为:SO2 + H2O + 2ClO— 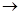 SO32— + 2HClO SO32— + 2HClOC.少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2 + H2O + ClO— 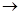 HCO3— + HClO HCO3— + HClOD.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能 参考答案:CD 本题解析:在相同温度下,酸的电离平衡常数越小,其相应的盐水解程度越大,溶液的碱性就越强,即pH越大。若盐溶液的pH相同,则电离平衡常数大的相应的盐浓度大,电离平衡常数小的相应的盐浓度小。A.电离平衡常数HCO3-< HSO3-<HClO<CH3COOH。所以等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量浓度最小的是Na2CO3。但是浓度小,物质的量不一定小。错误。B. SO2有还原性,NaClO有氧化性,二者发生氧化还原反应。反应方程式为:SO2 + H2O + ClO—=SO42— + 2H++Cl-。错误。C.少量CO2通入Ca(ClO)2溶液中,由于酸性H2CO3>HClO> HCO3-。根据强酸制取弱酸的性质。反应的离子方程式为: CO2 + H2O + ClO—= HCO3— + HClO。正确。D.若温度不变,向pH=a的醋酸溶液中加一定量水,若原来是稀溶液,稀释作用大于平衡正向移动是c(H+)增大的趋势,所得溶液的pH>a;若原来是浓溶液,加水时使酸分子的电离作用大于水的稀释作用,平衡正向移动是c(H+)增大的趋势,所得溶液的pH<a;若加水时使酸分子的电离作用等于加水对溶液的稀释作用,平衡不发生移动pH=a。故三种情况均有可能。正确。 本题难度:一般 3、选择题 将0.1mol·L-1醋酸溶液加水稀释,下列说法正确的是 参考答案:C 本题解析: 本题难度:一般 4、填空题 pH=12的氢氧化钠溶液稀释100倍后,pH=? 参考答案:10 本题解析:略 本题难度:简单 5、填空题 (1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。 参考答案:(1)碱性,>; (2)酸性,<; 本题解析:(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,得到醋酸钠溶液,醋酸根离子水解,使溶液成碱性;所以钠离子的浓度大于醋酸根离子的浓度; 本题难度:困难 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质的量》.. | |