微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列排列顺序不正确的是
A.熔点:Al>K>Na
B.微粒的半径:Cl- >Na+>Mg2+>Al3+
C.热稳定性:HF>HCl>HBr>HI
D.结合质子能力:AlO-2>CO32->F-
参考答案:A
本题解析:A、K的原子半径比Na大,Na的金属键较K强,所以Na熔点较高,错误;B、微粒半径随电子层数增加而增大,随核电荷数增多而减小,所以Cl- 的电子层数最多,半径最大,Na+、Mg2+、Al3+的电子层数相同,离子半径取决于核电荷数,正确;C、同主族元素氢化物的稳定性随核电荷数增加而降低,正确;D、酸性强弱顺序是HAlO2<HCO3-<HF,酸性越弱,结合质子能力越强,所以结合质子能力:AlO-2>CO32->F-,正确,答案选A。
本题难度:一般
2、选择题 W、X、Y、Z为四种短周期元素,X、Z同主族。已知X的原子半径大于Z的原子半径;Y的阳离子比W的阳离子氧化性强;Y的阳离子、W的阳离子、Z的阴离子具有相同的电子层结构。下列叙述正确的是
A.原子半径:W>X >Y>Z
B.单质与盐酸反应速率:Y>W
C.X最低价氢化物的稳定性强于Z最低价氢化物
D.W的氢氧化物的碱性强于Y的氢氧化物
参考答案:D
本题解析:由题意可得,W、X、Y、Z为四种短周期元素在元素周期表中的位置如图所示:
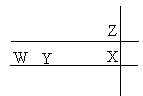 的以可得:
的以可得:
A错,原子半径:W>Y>X>Z;B错,由于W位于Y的前面,金属性更强,与盐酸反应速率更快;C错,氢化物的稳定性与非金属性强弱有关,由于X的非金属性小于Z,所以X最低价氢化物的稳定性弱于Z最低价氢化物;D正确,碱性强弱与元素的金属性强弱有关,金属性越强,对应的碱碱性越强,由于W的金属性大于Y,所以W的氢氧化物的碱性强于Y的氢氧化物;
本题难度:一般
3、选择题 下列说法正确的是
① C2H6分子中既含极性键又含非极性键?②由于氨和水分子之间能形成氢键,NH3分子极易溶于水?③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高?④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构?⑤原子序数为34号的元素属于长周期的副族元素?⑥由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
A.①②⑤⑥
B.①②③④
C.①②④⑤
D.②④③⑤
参考答案:B
本题解析:原子序数为34号的元素是Se,属于主族元素,选项⑤不正确;非金属性越强,最高价氧化物的水合物的酸性越强,而不是氢化物的酸性,选项⑥不正确,其余选项都是正确的,答案选B。
本题难度:一般
4、选择题 2011年3月11日,日本东部发生9.0级特大地震,引发海啸、福岛核泄漏、 环境污染等严重?问题。与此次危机有关的化学问题中,下列说法正确的是
A.碘虽然有助于防止核辐射,但服用过量,容易引发甲状腺疾病,因此不能盲目服用
B.福岛核电站泄漏的铯-137的放射性是化学性质
C.福岛核电站的燃料之一是钚(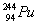 ),Pu在元索周期表中位于第六周期
),Pu在元索周期表中位于第六周期
D.在核辐射中对人体造成危害的碘是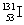 ,它是碘的一种放射性同位素,其质子数为78
,它是碘的一种放射性同位素,其质子数为78
参考答案:A
本题解析:
正确答案:A
B、不正确,放射性某些核素的原子核具有的自发放出带电粒子流或γ射线,或在俘获轨道电子后放出X射线或自发裂变的特性。不是化学变化。
C、不正确,Pu在元素周期表中位于第七周期
D、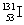 的质子数是53,中子数为78.
的质子数是53,中子数为78.
本题难度:一般
5、填空题 (13分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
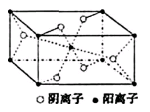
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。
参考答案:(1)1s22s22p4;Cl?(2)V形;O?(3)2:1
(4)2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
本题解析:X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体,该气体是NO2,则X是氮元素,Y是氧元素;X与氢元素可形成XH3,该气体是氨气;Z基态原子的M层与K层电子数相等,则该元素的原子序数是2+8+2=12,即为镁元素;R2+离子的3d轨道中有9个电子,因此R的原子序数是18+9+2=29,即为铜元素。
(1)氧元素的原子序数是8,则根据核外电子排布规律可知,氧元素基态原子的电子排布式是1s22s22p4;同周期自左向右元素的第一电离能逐渐增大,镁是第三周期,则所在周期中第一电离能最大的主族元素是Cl元素。
(2)根据价层电子对互斥理论可知,NO2-离子中心原子氮原子含有的孤对电子对数= ?=1,即氮原子的价层电子对数是3,由于含有一对孤对电子,因此其离子的立体构型是V形;铜离子含有空轨道,而水分子中的氧原子含有孤对电子,因此在Cu2+的水合离子中,提供孤电子对的是原子是O原子。
?=1,即氮原子的价层电子对数是3,由于含有一对孤对电子,因此其离子的立体构型是V形;铜离子含有空轨道,而水分子中的氧原子含有孤对电子,因此在Cu2+的水合离子中,提供孤电子对的是原子是O原子。
(3)根据晶胞结构可知,阳离子在8个顶点和体心处各一个,则根据均摊法可知,阳离子个数=1+8×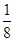 ?=2个。阴离子在上下面各2个,晶胞内部2个,则阴离子个数=4×
?=2个。阴离子在上下面各2个,晶胞内部2个,则阴离子个数=4×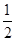 +2=4个,因此晶胞中阴离子与阳离子的个数之比是4:2=2:1。
+2=4个,因此晶胞中阴离子与阳离子的个数之比是4:2=2:1。
(4)将R单质的粉末加入氨气的浓溶液中,通入氧气,充分反应后溶液呈深蓝色,这说明在反应中铜被氧化氧化为铜离子与氨气结合形成配位键,则该反应的离子方程式是2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。
本题难度:一般