|
高中化学知识点总结《影响盐类水解的因素》高频试题预测(2017年最新版)(八)
2017-08-06 09:05:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 室温下,0.1mol/L的醋酸溶液的PH约为3,当向其中加入醋酸钠晶体溶解后发现溶液的PH变大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的PH增大。
(1)上述解释中?(填“甲”或“乙”)正确。
(2)为验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸中加入少量下列物质中的_____,然后测定溶液的PH值。
A.固体CH3COOK
B.固体CH3COONH4
C.NH3气体
D.固体NaHCO3
| (3) 若_____(填“甲”或“乙”)的解释正确,溶液的PH应_____(填“增大”、“减小”或“不变”)
(4)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有?种粒子
②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是?和?
③溶液中n(CH3COO-)+ n(OH-)-n(H+)= ?
参考答案:(1)乙⑵ B?⑶乙、增大?⑷① 7?②CH3COO-? CH3COOH?③0.006mol
本题解析:
(1)(2)(3)由题意知,溶液中存在两个平衡:CH3COOH CH3COO-+H+,CH3COO-+H2O CH3COO-+H+,CH3COO-+H2O CH3COOH+OH-。醋酸溶液中加入醋酸钠晶体,溶液的pH虽然增大,但只会小于7。因此CH3COOH的电离平衡占主导地位,乙同学的解释正确。为了验证两种解释哪种正确,就得选择一种含有CH3COO-但水解不显碱性的物质再实验,它只能是CH3COONH4。 CH3COOH+OH-。醋酸溶液中加入醋酸钠晶体,溶液的pH虽然增大,但只会小于7。因此CH3COOH的电离平衡占主导地位,乙同学的解释正确。为了验证两种解释哪种正确,就得选择一种含有CH3COO-但水解不显碱性的物质再实验,它只能是CH3COONH4。
(4)混合溶液中存在反应有:CH3COONa+HCl====NaCl+CH3COOH,NaCl====Na++Cl-,
CH3COOH CH3COO-+H+,H2O=====H++OH-。因此,溶液中存在Na+、Cl-、CH3COOH、CH3COO-、H2O、H+、OH-等7种粒子。根据物料守恒,n(CH3COOH)+n(CH3COO-)=n(Na+)=0.010mol,根据电荷守恒,n(CH3COO-)+c(OH-)+c(Cl)-=n(Na+)+n(H+),因此,n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。 CH3COO-+H+,H2O=====H++OH-。因此,溶液中存在Na+、Cl-、CH3COOH、CH3COO-、H2O、H+、OH-等7种粒子。根据物料守恒,n(CH3COOH)+n(CH3COO-)=n(Na+)=0.010mol,根据电荷守恒,n(CH3COO-)+c(OH-)+c(Cl)-=n(Na+)+n(H+),因此,n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。
本题难度:简单
2、选择题 弱酸酸式盐的酸根离子电离和水解并存,已知HSO3—电离大于水解。以NaHXO3表示NaHCO3和NaHSO3。对于NaHCO3和NaHSO3溶液,下列关系式中不正确的是(?)
A.c(Na+)+c(H+)=c(OH—)+c(HXO3—)+2c(XO32—)
B.c(Na+)= c(HXO3—)+ c(H2XO3)+c(XO32—)
C.c(Na+)> c(HXO3—)>c(H+)>c(OH—)
D.c(OH—)= c(H+)+ c(H2XO3)—c(XO32—)
参考答案:C
本题解析:C项:NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故C错误。故选C。
点评:本题考查离子浓度的大小比较,题目难度较大,解答本题时注意从守恒的角度分析,本题中还要注意题目要求,即浓度均为浓度均为0.1mol?L-1的NaHSO3溶液和NaHCO3溶液中均存在的关系,此为解答该题的关键之处,注意审题。
本题难度:一般
3、选择题 有下列四种溶液:①盐酸;②氯化铁;③氢氧化钠;④碳酸钠。它们的pH分别为4,4,10,10,溶液中水的电离度为α1,α2,α3,α4,则下列关系正确的是
A.α1=α2>α3=α4
B.α2=α4>α1=α3
C.α1=α2=α3=α4
D.α1=α3>α2=α4
参考答案:B
本题解析:反应H2O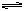 H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。 H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na2O,Na等。题中给出了四种溶液的溶质及pH,要求排列电离度α的顺序。只要表示出水电离出来的[H+]水或[OH-]水,然后直接比较其大小即可。
pH=4的盐酸:OH-为水电离产生的,[OH-]水=10-10mol/L
pH=4的FeCl3溶液,H+为水电离出来的,[H+]水=10-4mol/L
pH=10的Na2CO3溶液,OH-为水电离出来的,[OH-]=10-4mol/L
pH=10的NaOH溶液,H+为水电离出来的,[H+]=10-10mol/L
所以B的顺序是正确的。
本题难度:一般
4、选择题 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。
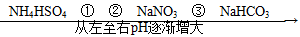
图中①②③可能是( )
A.NH4NO3、(NH4)2SO4、CH3COONa
B.(NH4)2SO4、NH4Cl、C6H5ONa
C.(NH4)2SO4、NH4NO3、Na2CO3
D.(NH4)2SO4、NH4NO3、CH3COONa
参考答案:D
本题解析:(NH4)2SO4溶液中c(NH4+)是NH4NO3溶液中c(NH4+)的2倍,所以(NH4)2SO4溶液中的酸性较强,(NH4)2SO4溶液的pH比NH4NO3溶液的小,A项不符合题意;酸性CH3COOH>H2CO3>  ?>HCO3—,所以同浓度的盐溶液,其pH大小顺序为 ?>HCO3—,所以同浓度的盐溶液,其pH大小顺序为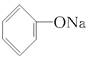 >Na2CO3>NaHCO3>CH3COONa,所以D项符合题意。 >Na2CO3>NaHCO3>CH3COONa,所以D项符合题意。
本题难度:一般
5、选择题 下列物质的水溶液呈碱性的是 (? )
A.氯化铵
B.硫酸钾
C.硝酸钠
D.醋酸钠
参考答案:D
本题解析:水溶液呈碱性,要么是碱溶液,要么是强碱弱酸盐。
A不是,氯化铵铵根离子水解,溶液呈酸性。
B不是,强酸强碱盐,中性。
C不是,强酸强碱盐,中性。
D正确,醋酸钠中醋酸根离子水解,溶液呈碱性。
本题难度:一般
|