微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是
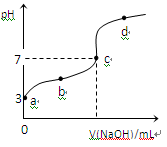
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液c(CH3COO-) > c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中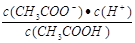 相等
相等
参考答案:C
本题解析:
答案C
恰好完全反应时,产物为CH3COONa,是强碱弱酸盐,水解后溶液呈碱性,pH>7
本题难度:一般
2、选择题 下列说法与盐类水解无关的是(?)
A.Na2CO3、NaHCO3被视作“碱”用于面食制作
B.NaHSO4溶液显酸性
C.铝盐可用作净水剂
D.TiCl4溶液经蒸干、焙烧制得TiO2
参考答案:B
本题解析:A? CO32-、HCO3-水解显碱性
B ?NaHSO4是强酸的酸式盐,全部电离,显酸性,不是水解导致
C? Al3+水解会得到Al(OH)3胶体可做净水剂
D ?Ti4+水解得Ti(OH)4和HCl,HCl挥发,使水解平衡右移,得到Ti(OH)4,在焙烧得TiO2
所以与水解无关的是B
本题难度:简单
3、选择题 下列浓度关系正确的是( )?
A.氯水中:c(Cl2)=2[C(ClO--) + C(Cl--) + C(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-) + C(OH--)
D.Na2CO3溶液中:c( Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
参考答案:D
本题解析:A 错误,氯元素主要以氯气形式存在在水中
B 错误, c(H+)>c(Cl-) >c(ClO-)>c(OH-)
C 错误,c(H+)+c(Na+)=c(CH3COO-) + C(OH--)
D 正确。
本题难度:一般
4、简答题 10℃时,在烧杯中加入0.1mol/L的?NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 50 | 70
pH
8.3
8.4
8.5
8.9
9.4
|
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为______;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的?NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.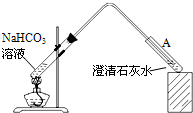
参考答案:(1)碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方程式为:HCO3-+H2O?H2CO3+OH-;
故答案为:HCO3-+H2O?H2CO3+OH-;
(2)碳酸钠是强碱弱酸盐能水解,碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度,
故答案为:大于;
(3)若加热后碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,温度不变溶液的PH值也不变,由此证明甲是正确的;PH>8.3,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,说明乙正确;
故答案为:═,>;?
(4)加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明加热分解算错了二氧化碳气体,证明乙正确;
故答案为:乙;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1,溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成;所以乙正确;
故答案为:乙;溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成;
本题解析:
本题难度:一般
5、选择题 下面提到的问题中,与盐的水解无关的是
①明矾和FeCl3可作净水剂
②实验室保存FeCl3溶液时,要在溶液中加少量盐酸.
③在NH4Cl或AlCl3溶液中加入金属镁会产生氢气.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞.
⑥长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用.
⑦比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性.
A.①④⑦
B.②⑤⑥
C.③⑥⑦
D.全有关.
参考答案:D
本题解析:略
本题难度:一般