|
高考化学必考知识点《影响盐类水解的因素》高频试题预测(2017年最新版)(八)
2017-08-06 09:08:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 SiO2、SO?2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
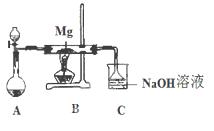
(1)选择制取SO2的合适试剂?(填编号)。
①浓HCl?②浓H2SO4?
③Na2SO3固体?④CaSO3固体
(2)上述装置还可优化,优化的方法是?,实验后装置C中所得溶液离子浓度关系一定正确的是(选填字母)
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
| (3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为?
乙同学的推测是:2Mg+3SO2 2MgSO3+S; 2MgSO3+S;
丙同学的推测是:3Mg+SO2 2MgO+MgS, 2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO?3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:
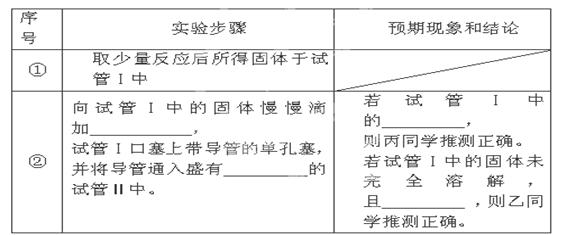
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是_________________ _
(4)上述实验需要50mL,2mol/L的HCl,配制时应选用?(10 mL ,25 mL ,,50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积。
参考答案:(1)②③(2分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分); D(2分)
(3)2Mg+SO2? ?2MgO+S;(2分) ?2MgO+S;(2分)
②
2mol/L 盐酸至过量(1分);
品红(1分)
固体完全溶解;(1分)
品红溶液褪色(1分);
?
向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无色气体产生)(2分)
(4)10ml
本题解析:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水);
(2)SiO2、CO2都是酸性氧化物,所以镁与玻璃中的二氧化硅能发生反应,镁不能与玻璃管直接接触;又因为镁与钠的性质相似,能与水反应,因此A、B间应加干燥装置;实验后装置C中为Na2SO3溶液,A、根据物料守恒可得:(Na+)= 2c(SO32-)+2 c(HSO3-)+2c(H2SO3),错误;B、Na2SO3分两步水解,以第一步为主,可得:(Na+)> c(OH-)> c(HSO3-)> c(SO32-)> c(H+),错误;C、根据质子守恒可得:(OH-)= c(HSO3-)+ 2(H2SO3)+ c(H+),错误;D、根据电荷守恒可得:(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-),正确。
(3)根据Mg与CO2的反应可类比得:2Mg+SO2? ?2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。 ?2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
(4)设需要浓盐酸的体积为V,可得:0.05L×2mol/L×36.5g/mol=V×1.19g/mL×36.5%,则V=8.4mL,所以选择10mL量筒量取。
本题难度:一般
2、选择题 将硫酸铵溶于水得无色溶液,为使该溶液中的铵根离子与硫酸根离子的物质的量浓度之比等于2,应当采取的措施是(?)
A.加入适量的硫酸溶液,抑制铵根离子的水解
B.加入适量的氨水,使pH值等于7
C.加入适量氢氧化钠,使溶液pH值等于7
D.加入适量硫酸钠,抑制硫酸铵电离
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列叙述错误的是 ( )
A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶
液中一定存在:c (K+)+ c (H+) =" c" (CH3COO-) + c (OH-)
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶
液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+)
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
参考答案:B
本题解析:A、电荷守恒,正确;B、c(ClO-) >c(OH-),OH-是水电离产生,很小,错误;C、HCO3-+OH-= CO32-+ H2O,Ba2++ CO32-=" Ba" CO3↓, c(OH-)="0.5" ,c (Ba2+)="0.2," c (Na+)="0.1," c (H+)由水电离产生的,很小,所以c (OH-) >c (Ba2+)>c (Na+)> c (H+),正确;D、CH3COOH溶液c (H+)等于pH=11的NaOH溶液的c(OH-),为10-3,Kw =10-14?,另外的H+?和OH- 相等,是水电离产生的,正确。
本题难度:一般
4、选择题 25°C时,在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的是:
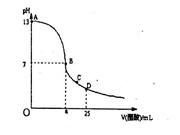
A.在A、B间任一点,溶液中一定都有c(Na+)﹥c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c,( CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+ )
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下列比较中,正确的是(? )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后:
c(NH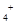 )>c(Cl )>c(Cl )>c(Na )>c(Na )>c(OH )>c(OH )>c(H )>c(H ) )
C.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na )+ c(H )+ c(H )=c(S )=c(S )+ c(HS )+ c(HS )+ c(OH )+ c(OH ) )
D.同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH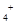 )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④
参考答案:D
本题解析:A、同温度同物质的量浓度时,HF比HCN易电离,说明HF的酸性比HCN的酸性强,根据盐的水解规律“越弱越水解”,二者的钠盐的水溶液均呈碱性,但NaCN的水解程度大于NaF的水解程度,所以NaCN溶液的pH值大,错误;B、物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后生成一水合氨与氯化钠,溶液呈碱性,离子浓度的大小关系是c(Cl )=c(Na )=c(Na )> c(OH )> c(OH )> c(NH )> c(NH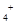 )> c(H )> c(H ),错误;C、物质的量浓度相等的H2S和NaHS混合溶液,根据电荷守恒规律有c(Na ),错误;C、物质的量浓度相等的H2S和NaHS混合溶液,根据电荷守恒规律有c(Na )+ c(H )+ c(H )=2c(S )=2c(S )+ c(HS )+ c(HS )+ c(OH )+ c(OH ),错误;D、同物质的量浓度的4种溶液中,①的铵根离子与铝离子水解都使溶液呈酸性,所以铝离子的存在抑制铵根离子的水解,铵根离子浓度最大;②中只发生铵根离子的水解;③中的醋酸根离子水解使溶液呈碱性,所以对铵根离子的水解起促进作用;④中只发生一水合氨的电离,电离程度很小,所以铵根离子浓度最小,因此c(NH ),错误;D、同物质的量浓度的4种溶液中,①的铵根离子与铝离子水解都使溶液呈酸性,所以铝离子的存在抑制铵根离子的水解,铵根离子浓度最大;②中只发生铵根离子的水解;③中的醋酸根离子水解使溶液呈碱性,所以对铵根离子的水解起促进作用;④中只发生一水合氨的电离,电离程度很小,所以铵根离子浓度最小,因此c(NH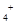 )由大到小的顺序是:①>②>③>④,正确,答案选D。 )由大到小的顺序是:①>②>③>④,正确,答案选D。
本题难度:一般
|  2MgSO3+S;
2MgSO3+S; 2MgO+MgS,
2MgO+MgS,