微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下盐溶液加热蒸干得不到原来的盐的是
A. Na2CO3?B. CuSO4?C. MgCl2?D KCl
参考答案:C
本题解析:C错,MgCl2溶液会水解生成氢氧化镁和HCL,由于HCL为易挥发性物质,加热蒸干最终得到的产物为氢氧化镁;
本题难度:简单
2、选择题 用0.10 mol/L 的盐酸滴定0.10 mol/L 的氨水,滴定过程中不可能出现的结果是
A.c(NH4+)>c(Cl ),c(OH
),c(OH )>c(H
)>c(H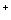 )
)
B.c(NH4+) = c(Cl ),c(OH
),c(OH ) = c(H
) = c(H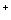 )
)
C.c(Cl )>c(NH4+),c(OH
)>c(NH4+),c(OH )>c(H
)>c(H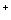 )
)
D.c(Cl )>c(NH4+),c(H
)>c(NH4+),c(H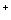 )>c(OH
)>c(OH )
)
参考答案:C
本题解析:
不管滴定过程处于哪个阶段,溶液中始终只有NH4+、Cl 、OH
、OH 、H
、H 四种离子,存在着电荷守恒c(NH4+)+ c(H
四种离子,存在着电荷守恒c(NH4+)+ c(H )=c(Cl
)=c(Cl )+c(OH
)+c(OH )。
)。
A.?首先符合电荷守恒,第一组离子阳离子浓度大于阴离子浓度,第二组离子阴离子浓度大于阳离子浓度。这时,应该是氨水大大过量,也就是氨水的量多于恰好中和时所需要的、与盐酸相同的物质的量,也多余使溶液呈中性时的氨水量,这时使浓度较大的氨水与浓度较小的氯化铵溶液的混合液。
B.?酸碱反应恰好使溶液呈中性,c(OH ) = c(H
) = c(H ),所以c(NH4+) = c(Cl
),所以c(NH4+) = c(Cl )
)
C.?两组结论都是阴离子浓度大于阳离子浓度,那么阴离子所带负电荷的总浓度就大于阳离子所带正电荷总浓度了,溶液不就成了带电的物体了吗?明显不符合电荷守恒的原理。
D.?两组结论符合电荷守恒,这是盐酸量多,氨水量少的情况。
本题难度:一般
3、选择题 0.1 mol·L—1NH4Cl溶液的pH最接近于
A.13
B.7
C.5.2
D.1
参考答案:C
本题解析:氯化铵溶液水解显弱酸性,排除A和B,当0.1 mol·L—1一元强酸全部电离时pH才等于1,盐溶液pH不可能等于1,故选C。
本题难度:简单
4、选择题 已知:NaA水溶液呈碱性,常温下将0.10molNaA和0.05molHCl溶于水,得到PH<7的溶液,则溶液中离子浓度关系正确的是(?)
A.c(A-)+c(OH-)=c(Na+)+c(H+)? B.c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(HA)+c(A-)=2c(Na+)? D.c(Na+)>c(Cl-)>c(A-)>c(H+)
参考答案:BC
本题解析:A 错误。c(Cl-)+c(A-)+c(OH-)=c(Na+)+c(H+)
B 正确,NaA水溶液呈碱性,说明是强碱弱酸盐,A-离子水解,所以,c(Na+)>c(A-)>c(H+)>c(OH-)
C 错误,c(HA)+c(A-)= c(Na+)
D 错误,c(Na+)>c(A-) >c(Cl-)>c(H+)
故选B。
本题难度:一般
5、填空题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
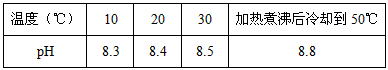
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式:____________________。
(2)乙同学类比加热Ca(HCO3)2溶液,会出现___________________现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断水解程度:Na2CO3_________NaHCO3(填“大于”或“小于”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明__________(填“甲”或“乙”)判断正确。试剂X是______________(填字母)
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH________(填“高于”、“低于”或“等于”)8.3,则说明另一判断正确。
参考答案:(1)HCO3-+H2O H2CO3+OH-
H2CO3+OH-
(2)浑浊;大于
(3)①乙;B;②等于
本题解析:
本题难度:一般