微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
| A | B | C | D | E | F | G | H | I | J
原子半径(10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
0.102
0.037
|
最高或最低
化合价
+2
+1
+5
+7
+1
+5
+3
+6
+1
-2
-3
-1
-3
-2
|
回答下列问题:
(1)D的元素名称是______,H的元素符号是______.
B在元素周期表中的位置是(周期、族)______
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是______.
化合物F2A2的电子式是:______,构成该物质的化学键类型为______
(3)用电子式表示A的简单氢化物的形成过程如下:______;G的氢化物的结构式为______.
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6kJ热量,写出其热化学方程式______.
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:______.
参考答案:从图表数据可知,+1价的C、F,一定是碱金属Li和Na,而原子半径F>C,故C应为IA族第二周期的Li,F为三周期的Na元素,J为H元素;D和G最高正价均为+5,负价一致,故为VA族元素,因原子半径D>G,故D为第三周期第VA族的P元素,G为N元素;从化合价可推出E属于卤素,由于短周期F元素无正价,故E为氯元素,位于第VIIA族第三周期;H最高正价+3价,无负价,只能是IIIA族元素,而原子半径H>F,故H只能是位于第二周期第IIIA族的B元素;A和I的最低负价都为-2价,I最高正价为+6价,则A应为第二周期的O元素,I为第三周期的S元素.
(1)由以上分析可知,D为P元素,F为B元素,B为Mg元素,位于第三周期ⅡA族,故答案为:磷;B;第三周期?第ⅡA族;
(2)以上元素中,非金属性最强的元素为Cl元素,对应的最高价氧化物的水化物的为HClO4,酸性最强,化合物F2A2为Na2O2,为离子化合物,含有离子键和非极性共价键,
故答案为:HClO4;
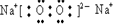
;离子键、非极性键;
(3)A的简单氢化物为H2O,用电子式表示的形成过程为
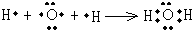
,G的氢化物为NH3,其结构式为
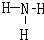
,
故答案为:
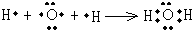
;
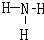
;
(4)IA2气体与足量的A单质充分反应为2SO2+O2

2SO3,
n(SO3)=20g80g/mol=0.25mol,
生成2molSO3放出的热量为:24.6kJ×8=196.8?kJ,
反应的热化学方程式为2SO2?(g)+O2(g)

2SO3(g);△H=-196.8?kJ/mol,
故答案为:2SO2?(g)+O2(g)

2SO3(g);△H=-196.8?kJ/mol;
(5)碱性氢氧燃料电池中,负极发生氧化反应,氢气得电子生成氢氧根离子,电极反应式为H2-2e-+2OH-═2H2O ,
故答案为:H2-2e-+2OH-═2H2O.
本题解析:
本题难度:一般
2、选择题 下列是含有共价键的离子化合物的是
[? ]
A.NaOH
B.CaCl2
C.NH4Cl
D.H2O2
参考答案:AC
本题解析:
本题难度:简单
3、简答题 有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 | 结构、性质等信息
X
构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体
Y
短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质
Z
与Y同周期,其最高价氧化物的水化物呈两性
M
海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂
|
请根据表中信息填写:
(1)X元素在周期表中的位置______;其相对分子质量最小的气态氢化物常用作______.
(2)工业上制取Y单质常用的方法是(用化学方程式表示)______.
(3)Y离子半径比Z离子的半径______(填“大”或“小”)
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于______(填“吸热”或“放热”)反应,写出反应的化学方程式______.
(5)举出实例说明M的非金属性比X强(用化学方程式表示)______.
参考答案:X为构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体,则X为C元素;Y为短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质,则Y为Na元素;Z为与Y同周期,其最高价氧化物的水化物呈两性,则Z为Al元素;M为海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则M为Cl元素,
(1)X为C,位于元素周期表中第二周期ⅣA族,其相对分子质量最小的气态氢化物为甲烷,可作燃料,故答案为:第二周期ⅣA族;燃料;
(2)工业上利用电解法冶炼Na,则化学反应为2NaCl(熔融)电解.2Na+Cl2↑,故答案为:2NaCl(熔融)电解.2Na+Cl2↑;
(3)Y为Na,Z为Al,二者的离子具有相同的电子,原子序数大的离子半径小,则Y离子半径比Z离子的半径大,故答案为:大;
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,为铝热反应,反应为2Al+Fe2O3高温.Al2O3+2Fe,该反应为放热反应,
故答案为:放热;2Al+Fe2O3高温.Al2O3+2Fe;
(5)由最高价含氧酸的酸性越强,对应非金属的非金属性越强,则Na2CO3+2HClO4=2NaClO4+CO2↑+H2O说明酸性为HClO4>碳酸,非金属性Cl>C,
故答案为:Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
本题解析:
本题难度:简单
4、填空题 【物质结构与性质】(8分)
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是??;O、N、S的第一电离能由大到小的顺序为?。
(2)铜的熔点比钙高,其原因是?;
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为?。

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有?(填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为?(填序号)。
A.平面正方形? B.正四面体? C.三角锥型? D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为?。
参考答案:(1)1s22s22p63s23p63d104s1 (1分)N>O>S (1分)
(2)晶体中铜的金属键强于钙?(2分)? 1:5(1分)
(3)①AC?(1分)? ②A?(1分)? ③sp2杂化(1分)
本题解析:
(1)铜原子的核外电子排布式是1s22s22p63s23p63d104s1,O、N、S的第一电离能由大到小的顺序为N>O>S,N原子的2P3为半充满结构,较稳定,第一电离能大于同周期的氧原子。
(2)铜的熔点比钙高,铜钙是金属晶体,说明铜的金属键强于钙;钙原子:8×1/8=1,铜:
8×1/2+1=5。
(3)①[Cu(NH3)4]2+中存在的化学键类型:Cu2+ 与NH3分子之间配位键,NH3中N―H键极性共价键,故选AC。
②如果是正四面体,两个NH3被两个Cl-取代后结构相同,A正确。
③HOCH2CH=CH2中两个SP2一个SP3, CH3CH2CHO中2个SP3,1个SP2, 在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为sp2杂化.
本题难度:一般
5、选择题 X、Y、Z三种原子序数依次增大的短周期元素,X、Y同族,Y、Z同周期.X原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
A.氢化物中共价键数目Z<X
B.Z元素最高价氧化物对应水化物的化学式为H2ZO3
C.物质的量浓度相同的Na2XO3和Na2YO3溶液,pH后者大于前者
D.含氧酸的酸性X<Z
参考答案:由题中信息可知X为C,Y为Si,Z可能为P、S、Cl等元素,则
A.X为C,最外层电子数为4,1个C原子最多可形成4的共价键,可形成共价键数目较多的烃类物质,故A正确;
B.Z可能为P、S、Cl等元素,对应的最高化合价为+5、+6、+7,而H2ZO3中Z的化合价为+4价,故B错误;
C.X为C,Y为Si,非金属性C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则对应的强碱盐碱性越弱,则物质的量浓度相同的Na2XO3和Na2YO3溶液,pH后者大于前者,故C正确;
D.由于对应的含氧酸不一定为最高价含氧酸,则无法比较酸性强弱,故D错误.
故选AC.
本题解析:
本题难度:一般