微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分 )Ⅰ.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
⑴.科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体
| NaCl
| KCl
| CaO
|
晶格能/(kJ·mol-1)
| 786
| 715
| 3 401
|
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ??。
⑵.科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
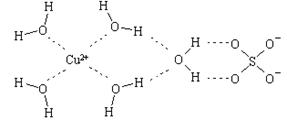
①写出基态Cu原子的核外电子排布式?
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)?
Ⅱ.常见有机化合物,如①CH2=CH2、②CH≡CH、③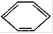 等,其中碳原子采取sp2杂化的分子有?(填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为?形。
等,其中碳原子采取sp2杂化的分子有?(填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为?形。
参考答案:Ⅰ.MgO>CaO>NaCl>KCl?
①1s22s22p63s23p63d104s1或[Ar] 3d104s1? ② ? Ⅱ.①③?平面三角
? Ⅱ.①③?平面三角
本题解析:Ⅰ.(1)根据数据可知形成离子键的离子半径越小,所带电荷数越多,离子键越强,晶格能越大。镁离子半径小于钙离子半径,所以氧化镁的晶格能大于氧化钙的,熔点由高到低的顺序是MgO>CaO>NaCl>KCl。
(2)①根据构造原理可知基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar] 3d104s1。
②胆矾晶体中水合铜离子是通过配位键形成的配合物,其中水是配体,所以结构简式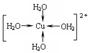 。
。
Ⅱ.碳碳双键是平面型结构,所以是sp2杂化。乙炔是直线型结构,碳原子是sp杂化。HCHO中碳原子和2个氢原子形成单键,和氧原子形成双键,所以是sp2杂化,属于平面三角形结构。
本题难度:一般
2、选择题 使用微波炉加热,具有使受热物质均匀受热、表里一致、速度快、热效率高等优点。其工作原理是通电后炉内的微波场以几亿赫兹的高频改变外电场的方向,水分子因而能迅速摆动,产生热效应,这是因为
[? ]
A.水分子具有极性共价键
B.水分子中有共用电子对
C.水由氢、氧两元素组成
D.水分子是极性分子
参考答案:D
本题解析:
本题难度:简单
3、选择题 韩国首尔大学的科学家将水置于一个足够强的电场中,在 20℃时水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是
[? ]
A.暖冰中水分子是直线形分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.暖冰中水分子的各原子均满足8电子稳定结构
D.暖冰与普通水的化学性质相同,物理性质不同
参考答案:D
本题解析:
本题难度:一般
4、填空题 短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z______W(填“>”、“<”或“=”,后同);电负性:X______Y.
(2)写出Q的价电子排布图______,YF3的结构式______.
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:______.
参考答案:短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X原子核外最外层电子数是次外层的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Z、W是常见金属,原子序数大于碳元素,常用第三周期,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,则W为Al元素、Z为Mg元素;Y的氟化物YF3分子中各原子均达到8电子稳定结构,Y为非金属性,则Y表现+3价,最外层电子数为8-3=5,处于ⅤA族,原子序数小于Mg元素,则Y为氮元素;Q处于第三周期,p能级上有一个未成对电子,外围电子排布为3s23p1或3s23p5,由于W为Al元素,则Q为Cl元素,
(1)Mg原子2s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能比Al元素的高;
同周期自左而右电负性增大,故电负性C<N,
故答案为:>;<;
(2)Q为Cl元素,外围电子排布为3s23p5,价电子排布图为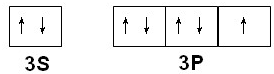 ,NF3中氮原子越氟原子之间形成1对共用电子对,结构式为:
,NF3中氮原子越氟原子之间形成1对共用电子对,结构式为: ,
,
故答案为: ;
; ;
;
(3)向硫酸铜溶液中逐滴滴入氨水溶液至过量,先生成氢氧化铜与硫酸铵,有蓝色沉淀生成,继续滴加过量的氨水,氢氧化铜与氨水反应生成四氨合铜络离子,蓝色沉淀消失,溶液呈深蓝色,反应离子方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性
B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在
C.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液,电池工作时溶液中的阴离子移向正极
D.能通过化合反应制得FeCl2和Fe(OH)3
参考答案:D
本题解析:A、钠还能与水反应生成氢氧化钠,错误;B、SO42-刚沉淀完时,铝以NaAlO2的形式存在,错误;C、电池工作时溶液中的阴离子移向负极,错误;D、是特殊反应,氯化铁和铁反应生成氯化亚铁,氢氧化亚铁与氧气、水反应生成氢氧化铁,均是化合反应,正确。
本题难度:一般