微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语,正确的是(?)
A.双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+===2Mn2++4O2↑+6H2O
B.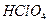 的电离方程式:
的电离方程式: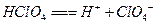
C.电解氢氧化钠溶液铁作阳极的电极方程式为: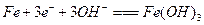
D.表示中和热的热化学方程式:2NaOH(aq)+H2SO4(aq) ===Na2SO4(aq)+2H2O(l)
参考答案:B
本题解析:略
本题难度:简单
2、选择题 能正确表示下列化学反应的离子方程式的是
A.氢氧化钡溶液与稀硫酸的反应 OH-+H+= H2O
B.氧化钙与稀盐酸反应 CaO + 2H+= Ca2+ + H2O
C.铁片插入硝酸银溶液中 Fe + Ag+= Fe2+ + Ag
D.碳酸钙溶于稀硝酸中 CO32++2H+=CO2?+H2O
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列反应的离子方程式不正确的是?(?)
A.Na2O2溶于水:2Na2O2+2H2O=4Na++4OH—+O2↑
B.少量烧碱滴入Ca(HCO3)2溶液:Ca2++2HCO3—+2OH—=CaCO3 ↓+2H2O+CO32—
C.金属钠投入水中:2Na+2H2O=2Na++2OH—+H2↑
D.氢氧化钠溶液吸收过量CO2: CO2+2OH-=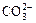 +H2O
+H2O
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列反应的离子方程式书写不正确的是( )
A.饱和的碳酸钠溶液中通入少量HCl气体:Na++CO32-+H+=NaHCO3↓
B.向AgNO3溶液中滴加过量氨水:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O
C.次氯酸钠溶液中通入少量的SO2气体:2ClO-+SO2+H2O=SO32-+2HClO
D.4mol?L-1的NaAlO2溶液和7mol?L-1的盐酸等体积混合:4AlO2-+7H++H2O=3A1(OH)3↓+Al3+
参考答案:A、饱和的碳酸钠溶液中通入少量HCl气体,碳酸钠和氯化氢反应生成碳酸氢钠和氯化钠,由于碳酸氢钠的溶解性小于碳酸钠,所以生成的碳酸氢钠会析出晶体,离子方程式为Na++CO32-+H+=NaHCO3↓,故A正确;
B、向AgNO3溶液中滴加过量氨水,生成的氢氧化银能溶于过量氨水生成银氨络合物,离子方程式为Ag++2NH3?H2O=[Ag(NH3)2]++2H2O,故B正确.
C、次氯酸钠溶液中通入少量的SO2气体,次氯酸会把二氧化硫氧化为硫酸,本身被还原为氯离子,故C错误;
D、4mol?L-1的NaAlO2溶液和7mol?L-1的盐酸等体积混合,4molAlO2-和7molH+反应;
?AlO2-+H++H2O=A1(OH)3↓;
4mol?4mol? 4mol
A1(OH)3+3H+=Al3++3H2O;
?1mol? 3mol? 1mol
所以离子方程式为:4AlO2-+7H++H2O=3A1(OH)3↓+Al3+
故D正确;
故选C.
本题解析:
本题难度:一般
5、简答题 请用适当的化学用语填空.
(1)Na2CO3水解的离子方程式:______;
(2)H2S电离方程式:______;
(3)AlCl3水解的离子方程式:______;
(4)在25℃、101kPa下,lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,写出表示甲烷燃烧热的热化学方程式:______;
(5)碱性氢氧燃料电池的两极电极方程式
负极:______;正极:______.
(6)写出NaHCO3溶液中的离子浓度关系
c(H+)+c(Na+)=______;
c(Na+)=______.
参考答案:(1)碳酸钠水溶液中水解,碳酸根离子是多元弱酸阴离子分步水解,水解的离子方程式为:CO32-+H2O?OH-+HCO3-,故答案为:CO32-+H2O?OH-+HCO3-;
(2)硫化氢是弱电解质,在水溶液中存在电离平衡,多元弱酸分步电离,电离的方程式为:H2S?H++HS-,故答案为:H2S?H++HS-;
(3)氯化铝水溶液中铝离子水解生成氢氧化铝和氯化氢,故答案为:Al3++3H2O?Al(OH)3↓+3H+;
(4)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol;
(5)氢氧燃料电池原理分析,氢气在负极失电子发生氧化反应,碱性溶液中生成水,负极电极反应为:2H2-4e-+4OH-=4H2O;氧气得到电子生成氢氧根离子,阳极电极反应为:O2+4e-+2H2O=4OH-,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;
(6)碳酸氢钠溶液中存在电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-);物料守恒是钠元素和碳元素的守恒,依据化学式可知钠元素和碳元素相同,碳元素的存在形式银碳酸氢根离子水解和电离发生改变,得到物料守恒为c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),
故答案为:c(OH-)+2c(CO32-)+c(HCO3-);c(HCO3-)+c(CO32-)+c(H2CO3).
本题解析:
本题难度:一般