微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如图.试回答:
(1)起始时,混酸中H2SO4的物质的量浓度为多少?
(2)起始时,混酸中盐酸的物质的量浓度为多少?
(3)B点时溶液的pH是多少?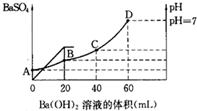
参考答案:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,
(1)设硫酸的物质的量为x,则
H2SO4+Ba(OH)2═BaSO4↓+H2O
?1? 1
?x? 0.02L×0.05mol?L-1
11=x0.02L×0.05mol/L,解得x=0.001mol,
硫酸的物质的量浓度为0.001mol0.02L=0.05mol?L-1,
答:起始时,混酸中H2SO4的物质的量浓度为0.05mol/L;
(2)设HCl的物质的量为y,则
H++OH-═H2O
1? 1
y? 0.04L×2×0.05mol/L
y=0.002mol,则盐酸的浓度为0.004mol0.02L=0.2mol/L,
答:起始时,混酸中盐酸的物质的量浓度为0.2mol/L;
(3)由图可知,B点硫酸完全反应,氢离子的浓度为0.2mol/L×0.02L0.02L+0.02L=0.1mol/L,所以pH=1,
答:B点时溶液的pH是1.
本题解析:
本题难度:一般
2、选择题 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+ 的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+ 物质的量分别(?)
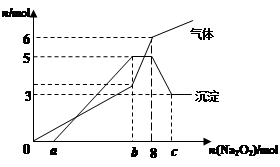
A.2 mol、3 mol、6 mol
B.3 mol、2 mol、6mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、2 mol
参考答案:D
本题解析:过氧化钠溶于水生成氢氧化钠,接下来的顺序依次为:与氢离子中和、镁离子和铝离子沉淀、与铵根离子反应、氢氧化铝溶解。结合沉淀图像分析,镁离子为3mol、铝离子为2 mol。结合气体图像分析,加入8mol过氧化钠时,共生成气体6mol,而2Na2O2——O2,8mol过氧化钠生成氧气4mol,所以生成氨气为2mol,铵根离子的物质的量为2mol,故D答案正确。
本题难度:一般
3、选择题 下列离子方程式书写正确的是( )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O
B.向铜作电极电解硫酸溶液:2H2O
2H2↑+O2↑
C.向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3-
D.向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑
参考答案:A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O,故A错误;
B.阳极铜失电子生成铜离子,阴极氢离子放电生成氢气:Cu+2H+电解.Cu2++H2↑,故B错误;
C.NaClO溶液具有氧化性,能将SO2氧化,当SO2气体过量时,SO2+ClO-+H2O=2H++SO42-+Cl-,故C错误;
D.钠先和盐中的水反应,然后生成的氢氧化钠再和氯化铝反应,即Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故D正确.
故选D.
本题解析:
本题难度:一般
4、填空题 短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物.请回答:
(1)X元素的名称是______;Y元素的名称是______;Z元素的名称是______.
(2)YZ4化合物的结构式是______,电子式是______.Y的最高价氧化物的电子式为______.
(3)写出Y的最高价氧化物与X的氢化物的水化物反应的离子方程式______.
参考答案:(1)由Y元素原子的最外电子层上的电子数是它的电子层数的2倍,可知Y为C.根据短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.Y电子层数是2,可知Z为H.且X是两个电子层,再根据X和Z可以形成XZ3的化合物,可知X为N.
(2)YZ4为CH4,结构式是
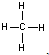
电子式为
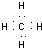
,Y的最高价氧化物为CO2.
(3)X的氢化物的水化物是NH3?H2O,Y的最高价氧化物为CO2,
二者反应的离子方程式为2NH3?H2O+CO2=2NH4++CO32-+H2O,
故离子方程式为2NH3?H2O+CO2=2NH4++CO32-+H2O.
故答案为:(1)氮? 碳 氢(2)

?
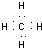
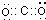
(3)2NH3?H2O+CO2=2NH4++CO32-+H2O
本题解析:
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式是
A.将铜屑加入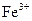 溶液中:2Fe3+ + Cu ="2" Fe2+ + Cu2+
溶液中:2Fe3+ + Cu ="2" Fe2+ + Cu2+
B.将磁性氧化铁溶于盐酸:Fe3O4 + 8H+ = 3Fe3+ + 4H2O
= 3Fe3+ + 4H2O
C.将氯化亚铁溶液和稀硝酸混合:Fe2+ + 4H+ + NO3— = Fe3+ + 2H2O + NO↑
D.将铁粉加入稀硫酸中:2Fe + 6H+ + = Fe3+ + 3H2↑
参考答案:A
本题解析:略
本题难度:一般