微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式书写正确的是( )
A.NH4HCO3溶液与过量NaOH溶液反应:N
+OH-=NH3↑+H2O
B.金属铝溶于氢氧化钠溶液:Al+2OH-=Al+H2↑
C.用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2=C+H2O
D.Fe2(SO4)3的酸性溶液中通入足量硫化氢:Fe3++H2S=Fe2++S↓+2H+
参考答案:A、NH4HCO3溶液与过量NaOH溶液反应,碳酸氢铵全部反应,离子方程式为;NH4++2OH-+HCO3-=NH3?H2O+CO32-+H2O;故A错误;
B、金属铝溶于氢氧化钠溶液反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;
C、用氢氧化钠溶液吸收少量二氧化碳反应的离子方程式为:2OH-+CO2=CO2-3+H2O,故C正确;
D、Fe2(SO4)3的酸性溶液中通入足量硫化氢发生氧化还原反应,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+;故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 下列反应的离子方程式中,书写正确的是
A.钠跟水反应: Na + 2H2O ="" Na+ + 2OH-+ H2↑
B.铁粉跟稀硫酸反应: 2Fe + 6H+ = 2Fe3++ 3H2↑
C.氢氧化钡溶液跟稀硫酸反应: Ba2+ + 2OH-+ 2H+ + SO42-= BaSO4↓+2 H2O
D.碳酸钙跟盐酸反应: CO32-+ 2H+ = H2O + CO2↑
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列离子方程式正确的是(?)
A.碳酸钙与盐酸反应 CO32 -+ 2 H+ = CO2↑+ H2O
B.金属铁放入稀盐酸中 Fe + 2H+ = Fe2+ + H2↑
C.氯化亚铁溶液中通入氯气 Fe2+ + Cl2 = Fe3+ + 2Cl-
D.金属钠与水反应: Na+H2O=Na++OH-+H2↑
参考答案:B
本题解析:碳酸钙是不溶物,应写化学式,A错;B正确;电荷不守恒,C错;质量不守恒,D错.
本题难度:一般
4、简答题 (16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:?。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是?。
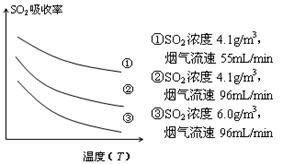
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则:?,
有利于提高SO2的吸收效率。
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_?(填字母)。
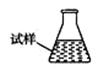 ?
?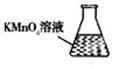

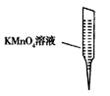 ?
?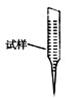
A? B? C? D? E
④ 滴定结果如下表所示:
滴定次数
| 待测溶液
的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 2.20
| 20.20
|
则该药品中Na2SO3的质量分数为_________。
参考答案:(16分)
(1)SO2+H2O H2SO3;2H2SO3+O2=2H2SO4?(2分)
H2SO3;2H2SO3+O2=2H2SO4?(2分)
(或2SO2+O2  2SO3;SO3+H2O=H2SO4?或2SO2+O2+2H2O=2H2SO4)
2SO3;SO3+H2O=H2SO4?或2SO2+O2+2H2O=2H2SO4)
(2)① 1.6?(2分)
② 2NaHSO3+O2=Na2SO4+H2SO4?(2分)
③ 降低含硫烟气的温度(或减小含硫烟气的流速)?(2分)
(3)① 2MnO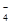 +5SO
+5SO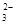 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO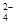 +3H2O ?(2分)
+3H2O ?(2分)
② 偏大 ?(2分)? ③ AC?(2分,漏选得1分,错选0分)
④ 63.00% 或63.0%?(2分,写“63%”得1分)
本题解析:(1)二氧化硫溶于水生成亚硫酸,亚硫酸与空气中的氧气反应生成硫酸,该过程的化学方程式为SO2+H2O H2SO3;2H2SO3+O2=2H2SO4?
H2SO3;2H2SO3+O2=2H2SO4?
(2)①根据电荷守恒,可得c(H+)+ c(Na+)= c(OH-)+2 c(SO32–)+c(HSO3–),所以c(HSO3–)= c(H+)+ c(Na+)- c(OH-)-2 c(SO32–)=(1.0+10-6-10-8-2×0.2)mol·L-1,所以c(HSO3–)近似为1.6mol/L;
②由①可知NaHSO3的溶液呈酸性,与氧气反应后生成的2种物质应是硫酸钠与硫酸,化学方程式为2NaHSO3+O2=Na2SO4+H2SO4;
③由图可知,二氧化硫的吸收率随温度升高而降低,①曲线的二氧化硫的吸收率最高,烟气的流速最小,所以提高SO2的吸收效率可以降低含硫烟气的温度(或减小含硫烟气的流速);
(3)①高锰酸钾溶液与亚硫酸钠发生氧化还原反应生成硫酸钠、硫酸锰、水,所以步骤iii所发生反应的离子方程式2MnO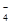 +5SO
+5SO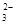 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO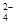 +3H2O;
+3H2O;
②配制高锰酸钾溶液时仰视定容,则所配溶液的浓度偏低,滴定时消耗高锰酸钾溶液的体积就偏大,造成最终测得药品中Na2SO3的含量偏大;
③根据实验步骤可知,样品溶液放在锥形瓶中,滴定溶液放在滴定管内,高锰酸钾具有强氧化性,所以应使用酸式滴定管,因此最合理的组合是AC;
④由表中数据可知3次使用高锰酸钾溶液的体积分别是20.01mL、19.99mL、18.00mL,第三组数据与前两组差距较大,舍去,用前两组的平均值计算,平均值是20.00mL。根据2MnO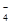 ~5SO
~5SO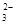 ,得样品中亚硫酸钠的质量为0.02L×0.01000 mol·L-1×2.5×10×126g/mol=0.63g,所以样品中亚硫酸钠的质量分数是0.63g/1.0000g×100%=63.00%。
,得样品中亚硫酸钠的质量为0.02L×0.01000 mol·L-1×2.5×10×126g/mol=0.63g,所以样品中亚硫酸钠的质量分数是0.63g/1.0000g×100%=63.00%。
本题难度:一般
5、选择题 下列用来表示物质变化的化学用语中,正确的是
A.甘氨酸与氢氧化钠溶液反应: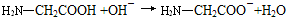
B.向苯酚钠溶液中通入少量的CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32-
2C6H5OH + 2CO32-
C.电解CuSO4溶液:Cu + 2H2O ="=" Cu2+ + H2 + Cu(OH)2
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e—=Fe2+
参考答案:A
本题解析:A:正确
B:产物中的碳酸盐一定为酸式盐,CO2 + H2O + C6H5O- C6H5OH + HCO3-
C6H5OH + HCO3-
C:电解产物不正确:2Cu2++2H2O=2Cu+O2↑+4H+
D:正极反应是得电子的反应,不正确
本题难度:一般