微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在重铬酸钾(K2Cr2O7)溶液中存在如下平衡: Cr2O72-+H2O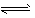 2HCrO4-
2HCrO4-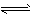 2H++2CrO42- ,向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
2H++2CrO42- ,向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
[? ]
A. Ag2Cr2O7
B. Ag2CrO4
C. AgHCrO4
D. Ag2O
参考答案:B
本题解析:
本题难度:一般
2、填空题 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2 Cu2++2OH-,Ksp=c(Cu2+)·[c(OH-)]2=
Cu2++2OH-,Ksp=c(Cu2+)·[c(OH-)]2=
2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于__________________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为__________________。
参考答案:(1)5
(2)6
本题解析:
本题难度:一般
3、选择题 已知25℃时,AgCl的溶度积K sp =1.8×10 -10,则下列说法正确的是
[? ]
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10mol2.L-2,在任何含AgCl 固体的溶液中,c(Ag+) =c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2.L-2
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大
参考答案:C
本题解析:
本题难度:一般
4、简答题 以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
| 沉淀物 | 开始沉淀pH | 沉淀完全pH
Al(OH)3
3.0
5.2
Fe(OH)3
1.5
2.8
Fe(OH)2
7.6
9.7
Mg(OH)2
8.0
12.4
|
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是______.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:______.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:______.
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为______≤pH<______.
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):______.
参考答案:(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4)?3+3H2O,
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;?
(2)因FeS2将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,用化合价升价法配平方程式,
故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,反应的方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3),
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3);
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,故答案为:2.8≤pH<3.0;
(5)滤液未沉淀的离子为Na+、Mg2+、Al3+,Al3+和NaOH反应:Al3++3OH-=Al(OH)3↓,若NaOH过量,NaOH与Al(OH)3反应:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O.
本题解析:
本题难度:一般
5、填空题 下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌
废水水质
| 经处理后的水国
家环保标准值
|
Zn2+浓度/(mg·L-1)
| ≤800
| ≤3.9
|
pH
| 1~5
| 6~9
|
SO42-浓度/(mg·L-1)
| ≤23 000
| ≤150
|
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为 mg·
L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17), (填“符合”或“不符合”)国家环保标准。
参考答案:(1)0.78 符合
本题解析:Ksp[Zn(OH)2]=c(Zn2+)·c2(OH-),c(Zn2+)=Ksp[Zn(OH)2]/c2(OH-),c(OH-)=10-14/10-8=10-6(mol·L-1),代入表达式中,得c(Zn2+)=1.2×10-17/(10-6)2=1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65×103 mg·mol-1=0.78 mg·L-1,对照表中的数据知,c(Zn2+)<3.9 mg·L-1,故符合标准。
本题难度:一般