微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 T°C向pH=6的蒸馏水中加入一定量的NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列有关叙述中不正确的是
[? ]
A.T>25℃
B.由水电离出来的c(H+)=1×10-10mol/L
C.c(H+)=c(OH-)+c(SO42-)
D.加入NaHSO4后水的电离程度增大
参考答案:D
本题解析:
本题难度:一般
2、填空题 测定石灰石中钙元素的质量百分含量时,都是先把钙元素全部转化为草酸钙沉淀 (CaC2O4?H2O),然后将草酸钙沉淀 (CaC2O4?H2O),用硫酸溶解,用a mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)。
(1)配平后离子方程式的系数依次为 、 、 、 、 、 。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、250mL容量瓶外,还需 。
(3)上述实验中的KMnO4溶液需要酸化,不能使用盐酸酸化的原因是 。
(4)开始取用样品的质量为m g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4溶液体积为 b mL,所得草酸溶液的物质的量的浓度是 ;石灰石中钙元素的质量百分含量为 。(相对原子质量:Ca—40)
参考答案:(19分)(1)5、2、6、2、10、8 (4分)(2)胶头滴管 量筒 (4分)
(3)KMnO4会把Cl-氧化而损耗 (3分)
(4)0.1ab mol/L; 40ab/m %或0.4ab/m×100% (8分)
本题解析:(1)根据方程式可知,在反应中碳元素的化合价从+3价升高到+4价,失去1个电子,则1mol草酸失去2mol电子。Mn元素的化合价从+7价降低到+2价,得到5个电子,即1mol高锰酸钾得到5mol,则根据电子的得失守恒可知,配平后的方程式是5H2C2O4 + 2MnO4- + 6H+ =2Mn2+ + 10CO2 ↑+ 8H2O。
(2)根据一定物质的量浓度溶液配制的要求可知,还缺少的仪器是胶头滴管和量筒。
(3)高锰酸钾具有强氧化性,KMnO4会把Cl-氧化而损耗,所以不能用盐酸酸化。
(4)根据方程式可知,所得草酸溶液的物质的量的浓度是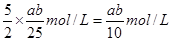 。根据原子守恒可知,石灰石中钙元素的质量百分含量为
。根据原子守恒可知,石灰石中钙元素的质量百分含量为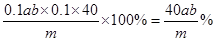 。
。
考点:考查氧化还原反应方程式的配平、物质的量浓度溶液的配制、物质中元素含量的测定和计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
3、填空题 (4分)请完成下列各空:
(1) pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”下同)
(2)0.1 mol·L-1CH3COONa溶液的pH 7
参考答案:(4分)(1) < (2) >
本题解析:(1)若醋酸为强酸,稀释100倍后溶液的H+浓度为原溶液的1/100,pH增大2,但CH3COOH溶液中存在电离平衡CH3COOH CH3COO-+H+,稀释时促进电离,使H+浓度增大,故pH<a+2
CH3COO-+H+,稀释时促进电离,使H+浓度增大,故pH<a+2
(2)CH3COONa溶液水解使溶液呈碱性:CH3COO-+H2O CH3COOH+OH-,故pH>7
CH3COOH+OH-,故pH>7
本题难度:一般
4、选择题 能使H2O+H2O=H3O++OH-电离平衡向正反应方向移动,且使所得溶液是酸性的措施是
[? ]
A.在水中加小苏打
B.在水中加稀醋酸
C.在水中加明矾固体
D.在水中加NaHSO4固体
参考答案:C
本题解析:
本题难度:一般
5、选择题 甲溶液的pH=6,乙溶液的pH=2,则下列叙述正确的是( )
A.甲、乙两溶液的c(H+)之比为400:1
B.甲中水的电离程度与乙中水的电离程度无法比较
C.甲中水的电离程度小于乙中水的电离程度
D.甲、乙两溶液均呈酸性