微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)已知NaHSO3溶液显酸性,而Na2SO3溶液显碱性。
(1)25℃时,在20.0mL0.5mol·L-1的NaOH溶液中,通入标准状态下的224mLSO2,所得溶液显______(填“酸”或“碱”)性,原因是_______________________________(用?化学用语表达),溶液中所含有的离子浓度由大到小的顺序为____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反应的离子方程式为____________________。当滴加NaClO至10mL时,溶液中由水电离的H+离子浓度为______________mol·L-1。滴加至20mL时溶液中离子浓度由大到小的顺序为_________________________。
(3)若在(2)反应后的溶液中滴加少量甲基橙,溶液显_________色。
参考答案:(1)酸(1分)? HSO3- H++SO32-?c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
H++SO32-?c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
(2)HSO3-+ClO-=SO42-+Cl-+H+? 3×10-14? c(Na+)>c(SO42-)=c(Cl-)>c(H+)>c(ClO-)>c(OH-)?(3)无?(其余每空2分)
本题解析:略
本题难度:简单
2、填空题 在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.升高温度,溶液的PH值减小
C.稀释溶液,溶液中c(H+)和c(OH-)都减少
D.加入NaOH固体,溶液pH减小
参考答案:A
本题解析:略
本题难度:一般
3、填空题 化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察 到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式____________。
(2) AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O混合共热,可得到无水AlCl3,其原因是______________。
参考答案:(1)SOCl2+H2O==SO2+2HCl
(2)若AlCl3溶液蒸干灼烧, AlCl3在水中存在如下平衡:AlCl3+3H2O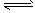 Al(OH)3+3HCl, 蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3
Al(OH)3+3HCl, 蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3 Al2O3+3H2O↑,因此固体产物主要为Al2O3,SOCl2和水反应生成SO2和HCl,一方面使水的物质的量减少,另一方面生成的酸抑制AlCl3的水解,所以SOCl2和AlCl3·6H2O共热可得AlCl3
Al2O3+3H2O↑,因此固体产物主要为Al2O3,SOCl2和水反应生成SO2和HCl,一方面使水的物质的量减少,另一方面生成的酸抑制AlCl3的水解,所以SOCl2和AlCl3·6H2O共热可得AlCl3
本题解析:
本题难度:一般
4、选择题 下列离子方程式中,属于水解反应的是(? )
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O HCO3-+H+
HCO3-+H+
C.CO32-+H2O HCO3-+OH-
HCO3-+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:A、D项分别表示HCOOH、HS-的电离过程,B项表示的是二氧化碳与水反应后生成碳酸的电离方程式,C项表示的是碳酸根离子结合水电离的氢离子生成碳酸氢根离子,属于水解反应。
本题难度:简单
5、选择题 下列有关物质浓度关系的描述,正确的是
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(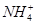 )>c(
)>c(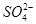 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(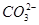 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度: