| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《氧化还原反应的基本概念》高频考点强化练习(2017年最新版)(三)
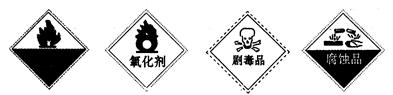 自燃物品?氧化剂?剧毒品?腐蚀品 A? B? C? D (3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO 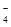 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。①该反应中发生还原反应的过程是__________________________________。 ②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数为_________。 (4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O==A+NH3↑,试指出生成物A的化学式为__________________,并阐明H2O2被称为“绿色氧化剂”的理由是_______________________________________________________________________。 2、填空题 3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O反应中,_________是氧化剂;_________是还原剂;_________元素被氧化;_________元素被还原;_________是氧化产物;_________是还原产物;被还原的HNO3与参加反应的HNO3物质的量之比是_________。 3、选择题 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是 4、选择题 锌加入很稀的硝酸后生成硝酸锌、硝酸铵和水。在这一氧化还原反应中,用于氧化1 mol Zn所需的HNO3的物质的量为(?) 5、选择题 下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《同分异构体.. | |