| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《氧化还原反应的基本概念》高频考点强化练习(2017年最新版)(四)
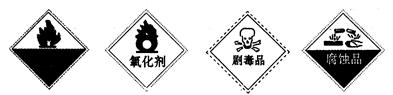 自燃物品?氧化剂?剧毒品?腐蚀品 A? B? C? D (3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO 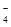 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。①该反应中发生还原反应的过程是__________________________________。 ②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数为_________。 (4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O==A+NH3↑,试指出生成物A的化学式为__________________,并阐明H2O2被称为“绿色氧化剂”的理由是_______________________________________________________________________。 参考答案:(1)? D?(2)? B 本题解析:考查氧化还原反应的相关知识 本题难度:一般 2、填空题 3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O反应中,_________是氧化剂;_________是还原剂;_________元素被氧化;_________元素被还原;_________是氧化产物;_________是还原产物;被还原的HNO3与参加反应的HNO3物质的量之比是_________。 参考答案:HNO3? Cu? Cu? N? Cu(NO3)2? NO? 1∶4 本题解析:根据给定的反应可知铜的化合价由0上升至+2,硝酸中氮元素的化合价由+5降低到+2,所以硝酸是氧化剂,铜是还原剂。 本题难度:简单 3、选择题 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是 参考答案:D 本题解析:解析: 本题难度:一般 4、选择题 锌加入很稀的硝酸后生成硝酸锌、硝酸铵和水。在这一氧化还原反应中,用于氧化1 mol Zn所需的HNO3的物质的量为(?) 参考答案:A 本题解析:由题意配平方程式为:4Zn+10HNO3====4Zn(NO3)2+NH4NO3+3H2O 本题难度:简单 5、选择题 下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是 参考答案:C 本题解析:考查金属性强弱比较。比较金属性强弱时,可以利用元素周期律、金属和酸或水反应生成氢气的难易程度、最高价氧化物的水化物的碱性强弱或金属单质之间的相互置换能力等。失电子的多少和金属性强弱无关,只与失去电子的难易程度有关系,越容易失去电子的,金属性越强。因此选项AD均不一定。金属性越强,相应阳离子的氧化性就越弱,B不正确。答案选C。 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《同分异构体.. | |